PAPIERY ORYGINALNE
Wykrywanie antygenu powierzchniowego zapalenia wątroby typu B przy użyciu połączonych surowic. A cost-benefit analysis
E. Fernández, L. Rodrigo1, S. García, S. Riestra1 i C. Blanco
Service of Biochemistry. Hospital de Cabueñes. Gijón. 1Serwis Gastroenterologii. Hospital Central de Asturias. Oviedo. Hiszpania
Korespondencja
ABSTRAKT
Cele: zbadanie wykonalności i przeprowadzenie analizy kosztów i korzyści strategii łączenia 5 próbek przy użyciu enzymatycznego testu immunologicznego (EIA) do badań przesiewowych antygenu powierzchniowego zapalenia wątroby typu B (HBsAg).
Materiał i metody: aby ocenić czułość i swoistość metody łączenia próbek, każda z 40 dodatnich surowic (od słabo do intensywnie HBsAg-dodatnich) i 250 ujemnych surowic było testowanych w puli z 4 surowicami HBsAg-ujemnymi. Granica wykrywalności dla HBsAg/ad i HBsAg/ay została oceniona przy użyciu surowic z panelu oczyszczonych podtypów. Badanie w warunkach rzeczywistych przeprowadzono z użyciem puli pochodzących od 340 kobiet w ciąży.
Wyniki: czułość i swoistość tej techniki wynosiła 100%. Współczynnik korelacji pomiędzy stosunkami próbka/odcięcie z 40 próbek badanych w warunkach pojedynczych i zbiorczych wyniósł 0,792 (p < 0,005). Metoda pooling charakteryzuje się niższym poziomem wykrywalności dla HBsAg/ad i HBsAg/ay wynoszącym odpowiednio 0,20 ng/mL i 0,12 ng/mL, a metoda pojedyncza odpowiednio 0,34 ng/mL i 0,29 ng/mL. Metoda łączenia nie traci czułości w przypadku wartości do 100 IU/L anty-HBs w czterech surowicach zmieszanych z surowicą dodatnią. Analiza kosztów i korzyści wykazała, że metoda łączenia może zaoszczędzić od 30% do 75% kosztów oznaczania HBsAg, w zależności od tego, czy częstość występowania seroprewalencji wynosiła odpowiednio 10% czy 1%.
Wnioski: łączone badanie HBsAg EIA dało wynik nie gorszy niż pojedynczy test EIA i było opłacalną i ważną strategią w obszarach o wysokiej, średniej lub niskiej częstości występowania.
Słowa kluczowe: Antygen powierzchniowy zapalenia wątroby typu B. Łączenie surowic. Analiza kosztów i korzyści.
Rodrigo L, Fernández E, García S, Riestra S, Blanco C. Hepatitis B surface antigen detection using pooled sera. A cost-benefit analysis. Rev Esp Enferm Dig 2006; 98: 112-121.
Wprowadzenie
Zakażenie wirusem zapalenia wątroby typu B (HBV) jest chorobą dotykającą miliony ludzi na całym świecie. Jej głównym rezerwuarem są przewlekli nosiciele HBV. Szacuje się, że około 300 milionów ludzi na całym świecie jest zakażonych tym wirusem (1). Konsekwencje medyczne zakażenia HBV są zarówno zmienne, jak i nieprzewidywalne, w zależności od takich czynników, jak wiek pacjenta i jego stan immunologiczny. HBV jest dobrze poznanym czynnikiem etiologicznym przewlekłego zapalenia wątroby, marskości wątroby i raka wątrobowokomórkowego.
Istnieją jednak duże różnice w częstości występowania zakażenia, co doprowadziło do wyodrębnienia trzech głównych obszarów o wysokiej, średniej i niskiej endemiczności (2). W większości krajów rozwiniętych częstość występowania przewlekłych nosicieli HBV jest mniejsza niż 2%, a do przeniesienia zakażenia dochodzi przede wszystkim u osób dorosłych należących do określonych grup ryzyka (narkomani, mężczyźni homoseksualni, heteroseksualiści promiskuistyczni, pracownicy służby zdrowia) (3). W Hiszpanii stwierdzono występowanie nosicieli HBV na poziomie 1,2% (4), a identyfikacja HBsAg u dawców krwi, kobiet w ciąży i osób poddawanych programom autotransfuzji jest obowiązkowa.
Technika łączenia surowic jest próbą obniżenia kosztów bez utraty skuteczności i jest stosowana głównie w krajach rozwijających się w poszukiwaniu przeciwciał przeciwko ludzkiemu wirusowi niedoboru odporności (HIV) (5-14) i wirusowi zapalenia wątroby typu C (HCV) (15-19). Wyniki uzyskane za pomocą tej metody okazały się bardzo obiecujące, ponieważ znacznie obniżyły koszty badań laboratoryjnych bez znaczącego zmniejszenia ich czułości.
W niniejszym badaniu podjęto próbę oceny, czy technika łączenia surowic może być stosowana w wykrywaniu HBsAg, aby wyjaśnić czynniki, które mogą modyfikować jej czułość oraz przeprowadzić analizę kosztów i korzyści dla tej techniki diagnostycznej.
Materiał i metody
Określanie HBsAg
Atest Imx HBsAg (Abbott Laboratories, Abbott Park, IL), który jest jakościowym, mikrocząsteczkowym testem immunoenzymatycznym trzeciej generacji (EIA), został użyty do oceny HBsAg. Obecność lub brak HBsAg jest określana przez porównanie szybkości tworzenia się produktu fluorescencyjnego z wartością graniczną, która jest obliczana na podstawie ujemnej wartości kalibratora (N) (ludzkie osocze niereaktywne dla HBsAg). Test Imx HBsAg oblicza stosunek tempa próbki (S) do tempa ujemnego kalibratora. Wartość odcięcia (S/N) została ustalona jako 2 dla pojedynczej surowicy EIA.
Technika łączenia jest wykonywana przez dodanie 200 mcL do puli, to jest przez uzyskanie mieszaniny 40 mcL każdej z 5 surowic tworzących pulę (rozcieńczenie 1/5). Wartość odcięcia została ustalona jako średnia dla próbek ujemnych plus 3 odchylenia standardowe, co daje wartość 1. Uznaje się zatem, że w tej grupie 5 próbek istnieje próbka niereaktywna, gdy współczynnik S/N wynosi < wartości odcięcia, podczas gdy S/N puli > wartości odcięcia może wskazywać na obecność co najmniej jednej próbki reaktywnej. W tym przypadku konieczne jest ponowne przebadanie poszczególnych próbek w celu zidentyfikowania próbki (próbek) reaktywnej. Wszystkie testy są wykonywane w dwóch egzemplarzach.
Zgodnie z powyższym, specyficzność została oceniona przez ocenę HBsAg w 50 pulach 250 ujemnych surowic. W celu obliczenia czułości, 40 surowic o takim samym rozkładzie stężeń jak populacja ogólna, z której zostały pobrane próbki, zostało przetestowanych w puli z 4 surowicami ujemnymi.
Podtypy HBsAg (ad i ay)
Granica wykrywalności Imx HBsAg dla ad i ay została oceniona przy użyciu surowic z panelu oczyszczonych podtypów HBsAg (panel czułości HBsAg w zapaleniu wątroby, Abbott Laboratories). Stężenia HBsAg/ad i HBsAg/ay wynosiły odpowiednio od 0,13 do 2,32 ng/mL i od 0,21 do 2,24 ng/mL. Granicę wykrywalności oznaczano w pojedynczych surowicach oraz w puli z 4 surowicami HBsAg ujemnymi.
Wpływ poziomu anty-HBs
W celu stwierdzenia, czy istnienie przeciwciał anty-HBs w surowicach badanych testem zbiorczym może neutralizować HBsAg i zakłócać czułość techniki, zastosowaliśmy metodę łączenia surowicy o znanym stężeniu HBsAg/ad i HBsAg/ay z czterema surowicami o znanym mianie anty-HBs.
Ilościowe oznaczanie anty-HBs przeprowadzono metodą mikrocząsteczkowego testu immunoenzymatycznego (mEIA) przy użyciu autoanalizatora AxSYm (AxSYmTM AUSAB, Abbott Laboratories, Abbott Park, IL). Surowice z wysokimi mianami anty-HBs uzyskano od osób kontrolnych po szczepieniu HBV i pacjentów, którzy wyzdrowieli z zapalenia wątroby typu B.
Pool-test w przesiewowym wykrywaniu HBsAg
W celu oceny zasadności testowania puli, przeprowadzono symulację operacji terenowych przy użyciu powyższej metody na 1525 próbkach surowicy uzyskanych od kobiet w ciąży w poprzednim badaniu przez nas w celu oszacowania częstości występowania zakażenia HCV, a których próbki były przechowywane w temperaturze -20 ºC od momentu pobrania. Spośród nich wybraliśmy losowo 300 próbek HBsAg ujemnych i 14 próbek HBsAg dodatnich. Oznaczenia zostały wykonane bez wcześniejszej wiedzy na temat składu puli.
Zmniejszenie liczby testów
Gdy wynik puli jest pozytywny, konieczne jest indywidualne ponowne przetestowanie każdego składnika w celu zidentyfikowania próbki lub próbek, które są HBsAg-dodatnie. W związku z tym, im większa jest liczba dodatnich zbiorów (to jest częstość występowania HBsAg), tym mniejsza jest redukcja liczby wykonywanych testów.
Na tej podstawie obliczono procent redukcji liczby testów, gdy zastosowano badanie przesiewowe zbioru surowic w kierunku HBsAg, w najbardziej niekorzystnych i mało prawdopodobnych warunkach (niska częstość występowania), to znaczy, gdy nie więcej niż jedna surowica dodatnia była obecna w żadnym z zbiorów. Na przykład, dla seroprewalencji HBsAg wynoszącej 2%, jeśli 100 surowic jest analizowanych w 20 pulach, 2 z nich będą pozytywne. Tak więc, konieczne jest dodanie 10 oznaczeń (10 surowic badanych indywidualnie) do 20 początkowych (20 basenów), co daje w sumie 30 oznaczeń. W tym przykładzie, można zaoszczędzić 70% kosztów. W celu przeprowadzenia analizy kosztów i korzyści, cena badania HBsAg została oszacowana na 3 dolary amerykańskie za każdą próbkę. Jest to oparte na średniej rzeczywistej cenie zestawu komercyjnego w naszym szpitalu.
Analiza statystyczna
Dane zostały zebrane w bazie danych, a następnie przeanalizowane przy użyciu pakietu statystycznego SPSS for Windows, Release 10.0. Zastosowano nieparametryczną korelację liniową Spearmana. Wyniki wyrażono jako średnie ± SD. Poziom p < 0,05 uznano za istotny statystycznie.
Wyniki
Żadna z 50 puli surowic HBsAg-ujemnych nie dała wyniku pozytywnego (S/N puli > 1), a uzyskano następujące wartości S/N puli: 0,767 ± 0,076 (zakres 0,67-0,88). W przypadku tej próbki swoistość techniki pooling wynosiła więc 100%. Z drugiej strony, wszystkie 40 surowic HBsAg-dodatnich, oznaczanych w formie puli, uzyskało wartości S/N większe od 1 (czułość również wynosiła 100%). Współczynnik korelacji między współczynnikami S/N dla tych 40 próbek, jak badano w pojedynczej i w puli, wynosił 0,792 (p < 0,05).
Dwadzieścia sześć punktów sześć procentowych puli z próbkami o wysokich mianach HBsAg miało współczynnik S/N nawet większy niż pojedyncza próbka. Jednak współczynnik korelacji próbek z niskimi mianami HBsAg (S/N pojedynczy < 25, n = 12) był doskonały (R = 0,9739, p < 0,05), jak widać (ryc. 1).

Granica wykrywalności przy użyciu pojedynczej metody wynosiła 0.34 ng/mL dla podtypu ad i 0,29 ng/mL dla podtypu ay, natomiast dla metody pooling wykryto niższe poziomy antygenu: odpowiednio 0,20 ng/mL i 0,12 ng/mL. Wyniki zastosowania techniki pojedynczej i zbiorczej do surowic o różnych stężeniach HBsAg/ad i HBsAg/ay przedstawiono na ryc. 2.

Gdy miano anty-HBs w puli jest mniejsze niż 100 IU/L, technika nie traci czułości; nawet gdy miano anty-HBs osiąga 10 000 IU/L, technika jest nadal zdolna do wykrywania stężeń HBsAg tak niskich jak 1,5 ng/mL. Przedstawiono wpływ różnych stężeń anty-HBs na granicę wykrywalności podtypów HBsAg przy zastosowaniu metody pooling (średnia z 2 oznaczeń) (ryc. 3).
W badaniu przeprowadzonym w warunkach rzeczywistych w surowicach kobiet ciężarnych, metoda pooling doprowadziła do prawidłowej klasyfikacji wszystkich analizowanych próbek. W związku z tym czułość i swoistość wynosiły 100%.
Wraz ze wzrostem seroprewalencji HBsAg maleje odsetek redukcji liczby badań uzyskany przy zastosowaniu metody łączenia. Można zauważyć, że nawet przy częstości występowania HBsAg wynoszącej 10% w badanej próbie, minimalna oszczędność wynosi co najmniej 30% (ryc. 4).

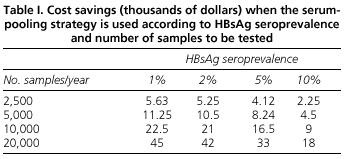
Analiza korzyści ekonomicznych strategii łączenia surowic pokazuje, że uzyskane oszczędności zależą zarówno od częstości występowania HBsAg, jak i od liczby oznaczeń, które należy wykonać. Tak więc, w przypadku krajów o niskiej częstości występowania, takich jak nasz, metoda łączenia zmniejsza koszty testowania dla HBsAg. Na przykład oszacowaliśmy, że w 2500 oznaczeń wykonanych w laboratorium w ciągu jednego roku przy użyciu metody pooling, oszczędności wyniosą 5 630 dolarów amerykańskich, a w przypadku bardzo zajętego szpitala wykonującego 20 000 oznaczeń rocznie, oszczędności sięgną 45 000 dolarów amerykańskich (Tabela I).
Dyskusja
Podejściem do metody łączenia jest utrzymanie rozcieńczenia i końcowej objętości mieszaniny reakcyjnej w każdym połączonym teście, aby nie stracić czułości, dla której rozcieńczalnik jest zmniejszany, a częściowo zastępowany przez dodatkowe surowice. W ten sposób nie jest konieczna modyfikacja wartości odcięcia w odniesieniu do metody standardowej w próbkach zindywidualizowanych. Jednakże, metoda zastosowana w naszym badaniu była zautomatyzowana, a rozcieńczenie próbki zostało wykonane przez autoanalizator. Z tego powodu, każda próbka wykazuje rozcieńczenie 1 do 5 po zmieszaniu z pozostałymi 4 surowicami. Dlatego w naszym badaniu konieczne było zmodyfikowanie wartości odcięcia i ograniczenie liczby surowic w puli, aby nie stracić czułości.
Jeśli chodzi o swoistość, należy zauważyć, że średnia wartość dla puli wynosiła tylko nieco ponad 3 odchylenia standardowe od wartości odcięcia. Tak więc, fałszywy wynik pozytywny może być oczekiwany w około 1% przypadków. Uważamy, że jest to akceptowalne, ponieważ swoistość wynosi prawie 100% (99,9%). Badanie z większą liczbą negatywnych próbek od dużej liczby różnych osób będzie wymagane w celu ustalenia prawdziwej specyficzności tego testu.
Chociaż korelacja między testowaniem pojedynczej i zbiorczej próbki jest dobra, linia regresji przecina oś X przy stosunku S/N równym 3 (odpowiadająca wartość Y wynosi 1). Może to oznaczać, że każda próbka o stosunku S/N między 2 a 3 w badaniu pojedynczej próbki miałaby wartość poniżej 1 i dlatego nie zostałaby wykryta w badaniu zbiorczym.
Dla częstości występowania 1% surowic HBsAg-dodatnich, model matematyczny opisany przez Liu i wsp. (19) osiągnął maksymalną redukcję (80,5%) liczby testów przy wielkości puli 11 surowic. Jednakże, naszym zdaniem, może pojawić się problem ze specyficznością ze względu na wpływ łączenia na wskaźnik fałszywie dodatnich wyników. Wzrost ilości niespecyficznych białek, w wyniku mieszania surowic, może spowodować wzrost koloru tła. Przy wielkości puli 5 wybranej do naszego badania i zmianie wartości odcięcia z 2 na 1, nie zaobserwowano żadnych strat w czułości (fałszywie ujemnych) lub swoistości (fałszywie dodatnich).
Wyniki obecnego badania pokazują, że technika łączenia surowic do wykrywania HBsAg jest wysoce czuła i swoista, a także pozwala na znaczne oszczędności ekonomiczne. Wyniki te są podobne do wyników uzyskanych przez innych badaczy, którzy zastosowali metodę łączenia surowic do badania zakażeń HCV i HIV (5-19). Do chwili obecnej opisano tylko dwa badania (20,21) dotyczące zastosowania metody pooling w badaniach nad zakażeniem HBV. W jednym z nich (20), przeprowadzonym podczas wykonywania rutynowych badań przesiewowych w kierunku wirusowego zapalenia wątroby typu B poprzez badanie 10 puli próbek, autorzy stwierdzili niską częstość występowania przewlekłych nosicieli (0,43%) i doszli do wniosku, że jest to metoda efektywna kosztowo i stanowi właściwą strategię na obszarach o niskiej seroprewalencji, przy obniżeniu czułości szacowanym na 4,2%. Zastosowanie w naszym badaniu metody pooling u kobiet w ciąży, wśród których częstość występowania przewlekłych nosicieli HBsAg wynosi 0,93%, wykazało czułość i swoistość na poziomie 100%.
Rozkład dwóch głównych podtypów HBsAg (ad i ay) w naszym środowisku wynosi około 50% dla każdego z nich, przy czym ay jest częstszy u narkomanów stosujących drogę parenteralną (22). Wykazaliśmy, że metoda pooling poprawia czułość, czyli obniża granicę wykrywalności testu immunologicznego stosowanego do oznaczania dwóch głównych podtypów HBsAg. Nasza technika poolingu pozwala na wykrycie ilości już 0,20 ng/mL HBsAg/ad i 0,12 ng/mL HBsAg/ay, nawet niższych niż te uzyskane metodą standardową. Stwierdzenie zwiększonej czułości przy zastosowaniu testu puli nie jest zaskakujące, ponieważ donosili o tym inni autorzy (16). Ważna jest ocena czułości zestawu EIA używanego do testu puli, ponieważ nie wszystkie zestawy mogą być odpowiednie do przesiewowego badania puli, jak wykazano w przypadku przeciwciał przeciwko wirusowi zapalenia wątroby typu C (23,24).
Obecność anty-HBs w surowicach puli może modyfikować czułość techniki, ale tylko w sposób znaczący w mianach wyższych niż 10 000 IU/mL, obserwowanych tylko w próbkach z badań kontrolnych po szczepieniu; w tej sytuacji oznaczanie HBsAg nie jest wskazane. W rzeczywistości, Cunninghan i wsp. (20) stwierdzili, że tylko 4,5% puli utworzonych z surowic kobiet ciężarnych miało miano anty-HBs większe niż 7500 IU/L. Biorąc pod uwagę to ograniczenie czułości metody poolingu, stwierdzili oni, że czułość i swoistość wynosiła również około 100%. Nasze wyniki mogą być powtarzalne w innych obszarach o niskiej częstości występowania, ale powinny być wcześniej zademonstrowane w obszarach o wysokiej endemiczności HBV. Na tych obszarach większość populacji jest już uodporniona przeciwko temu wirusowi i możliwe jest, że miana anty-HBs wykryte w surowicy są nieznacznie podwyższone.
Rabenau i wsp. (21) badali bezpieczeństwo testów serologicznych w pulach osocza dla HBsAg przy użyciu systemu EIA podobnego do naszego. W ich badaniu na wykrycie HBsAg miała wpływ obecność niskich mian anty-HBs po 5 godzinach inkubacji. Jednakże, po dysocjacji kompleksu immunologicznego, HBsAg był nadal wykrywalny w puli, nawet w obecności wysokiej zawartości anty-HBs. W naszych badaniach wykazaliśmy, że tylko dla mian anty-HBs wyższych niż 10,000 IU/L obserwuje się znaczny spadek czułości. Różnice te mogą wynikać z faktu, że w naszym przypadku próbki były badane bez uprzedniej inkubacji. Może to zapobiec neutralizacji antygenu przez tworzenie immunokompleksu.
Dlatego uważamy, że zarówno miano anty-HBs w surowicy, jak i przetwarzanie próbek przed badaniem za pomocą EIA może wpływać na czułość metody łączenia. Każde laboratorium chcące stosować tę technikę powinno pamiętać o tych dwóch czynnikach przed wprowadzeniem jej do powszechnego użytku.
WHO zaleca stosowanie metody łączenia surowic w przypadku zakażenia HIV, gdy częstość występowania choroby jest mniejsza niż 2% i przy maksymalnym łączeniu 5 surowic (25). Zgodnie z tymi wskazaniami, większość badań stosuje i zaleca stosowanie technik łączenia surowic w obszarach o niskiej częstości występowania. W naszym badaniu wykazaliśmy, że łączenie surowic może być również opłacalne w populacjach o wysokiej częstości występowania nosicieli HBsAg. Może to pozwolić na jego zastosowanie w krajach należących do obszarów o średniej i wysokiej endemiczności zakażeń HBV, co na ogół pokrywa się z krajami słabo rozwiniętymi lub rozwijającymi się, czyli takimi, w których istnieje większa potrzeba redukcji kosztów ekonomicznych związanych z badaniami laboratoryjnymi. Niemniej jednak, aby potwierdzić nasze wyniki, konieczne będzie przeprowadzenie podobnych badań na tych obszarach. Wykazano już jednak, że w krajach takich jak Kenia, gdzie częstość zakażeń wirusem HIV jest wysoka (7,3%), zastosowanie poolingu do jego wykrywania pozwoliłoby na 62% oszczędności ekonomiczne bez znaczącej utraty bezpieczeństwa (14). W Hiszpanii, kraju należącym do obszaru o niskiej endemiczności zakażeń HBV, w którym częstość nosicieli HBsAg w populacji ogólnej wynosi 1,2% (4), można go stosować we wszystkich tych grupach, w których badania przesiewowe w kierunku HBsAg są obecnie obowiązkowe (np. dawcy krwi, osoby poddawane programom autotransfuzji, badania przesiewowe kobiet w ciąży).
Badanie kosztów i korzyści zastosowania technik wykrywania przewlekłych nosicieli HBV pozwala wykazać, że oszczędności ekonomiczne są większe w przypadku wykonywania dużej liczby oznaczeń w grupach o niskiej seroprewalencji, a ich zastosowanie może być również opłacalne na obszarach o wysokiej prewalencji zakażenia, a nawet w laboratoriach wykonujących niewielką liczbę oznaczeń. Wykazaliśmy oszczędności kosztów ekonomicznych zarówno w zależności od różnej częstości występowania HBsAg, jak i liczby badań wykonywanych rocznie. W naszym regionie zastosowanie metody łączenia mogłoby zaoszczędzić około 74% całkowitych kosztów ekonomicznych w porównaniu do metody pojedynczej.
Niektórzy badacze zaczęli ostatnio praktykować strategie wykrywania wirusowych kwasów nukleinowych u dawców krwi przy użyciu łańcuchowej reakcji polimerazy (PCR) w celu zwiększenia bezpieczeństwa związanego z transfuzją krwiopochodnych (26-29). Ze względu na brak możliwości przeprowadzania indywidualnych badań przesiewowych ze względu na problemy ekonomiczne i nakład pracy, obecnie stosuje się metodę łączenia próbek krwi serologicznie ujemnych. Procedura ta może zwiększyć bezpieczeństwo krwi poprzez systematyczne badania przesiewowe oddawanej krwi przy stosunkowo niskich kosztach. Ponieważ jednym z głównych ograniczeń w stosowaniu tych metod są względy ekonomiczne, uważamy, że dzięki naszym badaniom można stworzyć teoretyczne podstawy do stosowania badań przesiewowych w kierunku zakażeń HBV, HCV i HIV w dwóch etapach przy stosunkowo niskich kosztach ekonomicznych. W pierwszej fazie komercyjna EIA mogłaby być zastosowana do puli surowic dawców; w drugiej fazie zastosowanie technik PCR do puli próbek seronegatywnych mogłoby zwiększyć bezpieczeństwo analizy. Dopóki przyszłe badania nie udowodnią wartości tej techniki z dawcami krwi, uważamy, że można ją zastosować tylko do badań diagnostycznych i epidemiologicznych.
Stwierdzamy, że zastosowanie EIA do połączonych surowic jest czułą i specyficzną metodą wykrywania dwóch głównych podtypów HBsAg w obszarze o niskiej częstości występowania. Czułość zmniejsza się tylko wtedy, gdy w połączonych surowicach występują bardzo wysokie miana anty-HBs. Technika łączenia surowic jest metodą, która może również pozwolić na oszczędności finansowe, jeśli zostanie zastosowana w badaniach populacji z wysoką częstością występowania nosicieli HBsAg. Uważamy, że konieczne są dalsze badania w celu potwierdzenia tych ustaleń.
Podziękowania
Pragniemy podziękować Davidowi H. Wallace’owi (członkowi Europejskiego Stowarzyszenia Redaktorów Naukowych i Rady Redaktorów Biologicznych) za angielskie tłumaczenie manuskryptu.
1. Maynard JE. Wirusowe zapalenie wątroby typu B: globalne znaczenie i potrzeba kontroli. Vaccine 1990; 8 (Supl.): 18s-20s.
2. Margolis HS, Alter MJ, Hadler SC. Wirusowe zapalenie wątroby typu B: epidemiologia ewolucji i implikacje dla kontroli. Sem Liver Dis 1991; 11: 84-92.
3. Alter MJ, Mast EE. The epidemiology of viral hepatitis in the United States. Gastroenterol Clin North Am 1994; 23: 437-55.
4. Suárez A, Riestra S, Navascués CA, et al. Positive HBsAg blood donors in Asturias (Spain): current prevalence and its significance. (streszczenie angielskie). Med Clin (Barcelona) 1994; 102: 329-32.
5. Emmanuel JC, Basset MT, Smith HJ, Jacobs JA. Pooling of sera for human immunodeficiency virus (HIV) testing: an economical method for use in developing countries. J Clin Pathol 1988; 41: 582-5.
6. Kline RL, Brothers TA, Brookmeyer R, et al. Evaluation of human immunodeficiency virus seroprevalence in population surveys using pooled sera. J Clin Microbiol 1989; 27: 1449-52.
7. Cahoon-Young B, Chandler A, Livermore T, et al. Sensitivity and specificity of pooled versus individual sera in a human immunodeficiency virus antibody prevalence study. J Clin Microbiol 1989; 27: 1893-5.
8. Frosner GG, Dobler G, von Sonnenburg FJ. Cost reduction of unlinked testing for anti-HIV by investigation of pooled sera. AIDS 1990; 4: 73-5.
9. Behets F, Bertozzi S, Kasali M, et al. Udane wykorzystanie połączonych surowic do określenia seroprewalencji HIV-1 w Zairze z opracowaniem modeli efektywności kosztowej. AIDS 1990; 4: 737-41.
10. Monzon OT, Paladin FJ, Dimaandal E, et al. Znaczenie zawartości przeciwciał i formatu testu w testowaniu HIV w połączonych surowicach. AIDS 1992; 6: 43-8.
11. Tamashiro H, Maskill W, Emmanuel J, et al. Reducing the cost of HIV antibody testing. Lancet 1993; 342: 87-90.
12. Perriens JH, Magazani K, Kapila N, et al. Zastosowanie szybkiego testu i testu ELISA do przesiewowego oznaczania przeciwciał HIV w zbiorczych próbkach surowicy w Lubumbashi, Zair. J Virol Methods 1993; 41: 213-21.
13. McMahon EJ, Fang C, Layug L, Sandler SG. Łączenie próbek dawców krwi w celu zmniejszenia kosztów testowania przeciwciał HIV-1. Vox Sang 1995; 68: 215-9.
14. Verstraeten T, Farah B, Duchateau L, Matu R. Pooling sera to reduce the cost of HIV surveillance: a feasibility study in a rural Kenyan district. Trop Med Int Health 1998; 3: 747-50.
15. Kamel MA, Ghaffar YA, Wasef MA, et al. High HCV prevalence in Egyptian blood donors. Lancet 1992; 340: 427.
16. Neil AGS, Conradie JD. Low cost anti-HCV screening of blood donors. Lancet 1992; 340: 1096.
17. Fernández E, Riestra S, García S, Rodríguez S. Pool tests for detection of hepatitis C virus infection. J Hepatol 1995; 23: 236.
18. García Z, Taylor L, Ruano A, et al. Evaluation of a pooling method for routine anti-HCV screening of blood donors to lower the cost burden on blood banks in countries under development. J Med Virol 1996; 49: 218-22.
19. Liu P, Shi ZX, Zhang YC, et al. A prospective study of a serum-pooling strategy in screening blood donors for antibody to hepatitis C virus. Transfusion 1997; 37: 732-6.
20. Cunningham R, Northwood JL, Kelly CD, et al. Routine antenatal screening for hepatitis B using pooled sera: validation and review of 10 years experience. J Clin Pathol 1998; 51: 392-5.
21. Rabenau H, Schutz R, Berger A, et al. Jak dokładne jest serologiczne badanie puli osocza dla antygenu powierzchniowego wirusa zapalenia wątroby typu B, anty-ludzkiego wirusa niedoboru odporności 1 i 2, i anty-wirusa zapalenia wątroby typu C? (Engl abstract). Infus Transfus 1996; 23: 124-30.
22. Echevarría JE, León P, López JA, et al. HBsAg subtype distribution among different populations of HBsAg carriers in Spain. Eur J Epidemiol 1995; 11: 39-45.
23. Neill AGS, Conradie JD. Pool tests for hepatitis C virus. Lancet 1994; 343: 738.
24. Liu P, Shi ZX, Zhang YC, Zhang XY. Comparative study on 4 EIA kits for screening antibody to hepatitis C virus in pooled sera. Biomed Environ Sci 1998; 11: 75-80.
25. Recommendations for testing for HIV antibody on serum pool. WHO Weekly Epidemiol Rec 1991; 44: 316-27.
26. Lefrere JJ, Coste J, Defer C, et al. Screening blood donations for viral genomes: multicenter study of real-time simulation using pooled samples on the model of hepatitis C virus RNA detection. Transfuzja 1998; 38: 915-23.
27. Yerly S, Pedrocchi M, Perrin L. Zastosowanie łańcuchowej reakcji polimerazy w pulach osocza do równoczesnego wykrywania RNA wirusa zapalenia wątroby typu C i HIV typu 1. Transfusion 1998; 38: 908-14.
28. Schottstedt V, Tuma W, Bunger G, Lefevre H. PCR for HBV, HCV and HIV-1 experiences and first results from a routine screening programme in a large blood transfusion service. Biologicals 1998; 26: 101-4.
29. Morandi PA, Schockmel GA, Yerly S, et al. Detection of human immunodeficiency virus type 1 (HIV-1) RNA in pools of sera negative for antibodies to HIV-1 and HIV-2. J Clin Microbiol 1998; 36: 1534-8.
Dodaj komentarz