Grupa 13 elementy obejmują metale po przejściu.
Termin metale po przejściu odnosi się do tych elementów, które są metalami po metali przejściowych. Podobnie jak w przypadku koncepcji metaloidu nie ma powszechnej zgody co do tego, co dokładnie jest metalem po przejściu. Na szczęście w praktyce mniej ważne jest dokładne zdefiniowanie, co jest, a co nie jest metalem po przejściu, niż zrozumienie powodu, dla którego pomocne może być klasyfikowanie pierwiastków jako metali po przejściu.
Głównymi cechami metali po przejściu jest to, że są one stosunkowo bogate w elektrony i elektronegatywne w porównaniu z tym, co klasycznie uważa się za metal. W przybliżeniu, to przekłada się na stosunkowo niższe temperatury topnienia (ponieważ więcej anty-wiążące poziomy w strukturze pasma mają tendencję do być zajęte), zwiększone preferencje dla kowalencji i większą kruchość niż inne metale (ze względu na wynikające wiązanie kierunkowe). Ich bogactwo elektronowe oznacza, że mają one tendencję do tworzenia miękkich kationów.
Do klasyfikacji pierwiastków jako należących do metali po okresie przejściowym stosuje się kilka systemów. Główne z nich obejmują:
- Metale, które następują po bloku d. Według tej definicji zalicza się do nich tylko metale z grup 13 i wyższych oraz rzędów 3 i wyższych, które tworzą stosunkowo miękkie i bogate w elektrony kationy oraz wykazują znaczną kowalencyjność w swoim wiązaniu. Jednakże, jeśli ten schemat jest przyjęty zbyt sztywno Al jest wykluczony, ponieważ technicznie nie jest zgodny z d-blokiem (i ma niewypełnioną podpowłokę (n-1)d), a metaloidy są wykluczone, mimo że wiele z nich również tworzy stosunkowo miękkie i bogate w elektrony kationy z wypełnionymi podpowłokami (n-1)d. Inną wadą tego systemu jest to, że wikła on kwestię, które elementy powinny być klasyfikowane jako metale potransformacyjne z drażliwą kwestią, które elementy powinny być klasyfikowane jako metale vs. metaloidy.
- Metale i metaloidy bloku p. System ten ma tę zaletę, że podkreśla ciekawe i unikalne właściwości metali i metaloidów z p-bloku, jak również ciągłości w tych właściwościach przez p-blok. W związku z tym, będzie on używany w sekcjach, które następują. Ma jednak wadę polegającą na wykluczeniu metali takich jak Zn, Cd i Hg, które są źródłem wielu związków, w których metal ma konfigurację (n-1)d10.
- Metale, które podążają za pierwiastkami przejściowymi w sensie tworzenia jonów z całkowicie pełną (n-1)d powłoką walencyjną czasami wraz z Al i metaloidami bloku p. Definicja ta dodaje Zn, Cd, i Hg (i czasami Cu, Ag, i Au), ponieważ tworzą one jony o konfiguracji (n-1)d 10 elektronów walencyjnych, takie jak Zn2+, Cd2+ i Hg2+ (i Cu+, Ag+, i Au+). Ponieważ w tym rozdziale rozważane są tylko pierwiastki bloku p dla celów tego rozdziału system ten jest funkcjonalnie identyczny z systemem 2.
Niezależnie od tego, jaki schemat klasyfikacji zostanie zastosowany, często bardziej pomocne jest myślenie o klasyfikacji pierwiastków jako metali potransitonowych jako o sposobie podkreślenia podobieństw we właściwościach chemicznych zestawu pierwiastków niż jako o sposobie podkreślenia, jak metale potransitonowe różnią się od innych metali. Metale potransformacyjne nie są jedynymi, które tworzą miękkie kationy lub związki lepiej opisane jako utrzymywane razem przez wiązania kowalencyjne. Jak wynika z poprzednich rozdziałów, nawet metale alkaliczne w odpowiednich okolicznościach tworzą aniony, a wiele związków metali lepiej opisywać w kategoriach kowalencyjności niż oddziaływań jonowych. Było to już widoczne w chemii metali ziem alkalicznych Be i Mg omówionych w poprzednim rozdziale. W kolejnych rozdziałach wiązanie i reaktywność w kompleksach koordynacyjnych i związkach metaloorganicznych będą w dużej mierze opisywane w kategoriach kowalencyjnych.
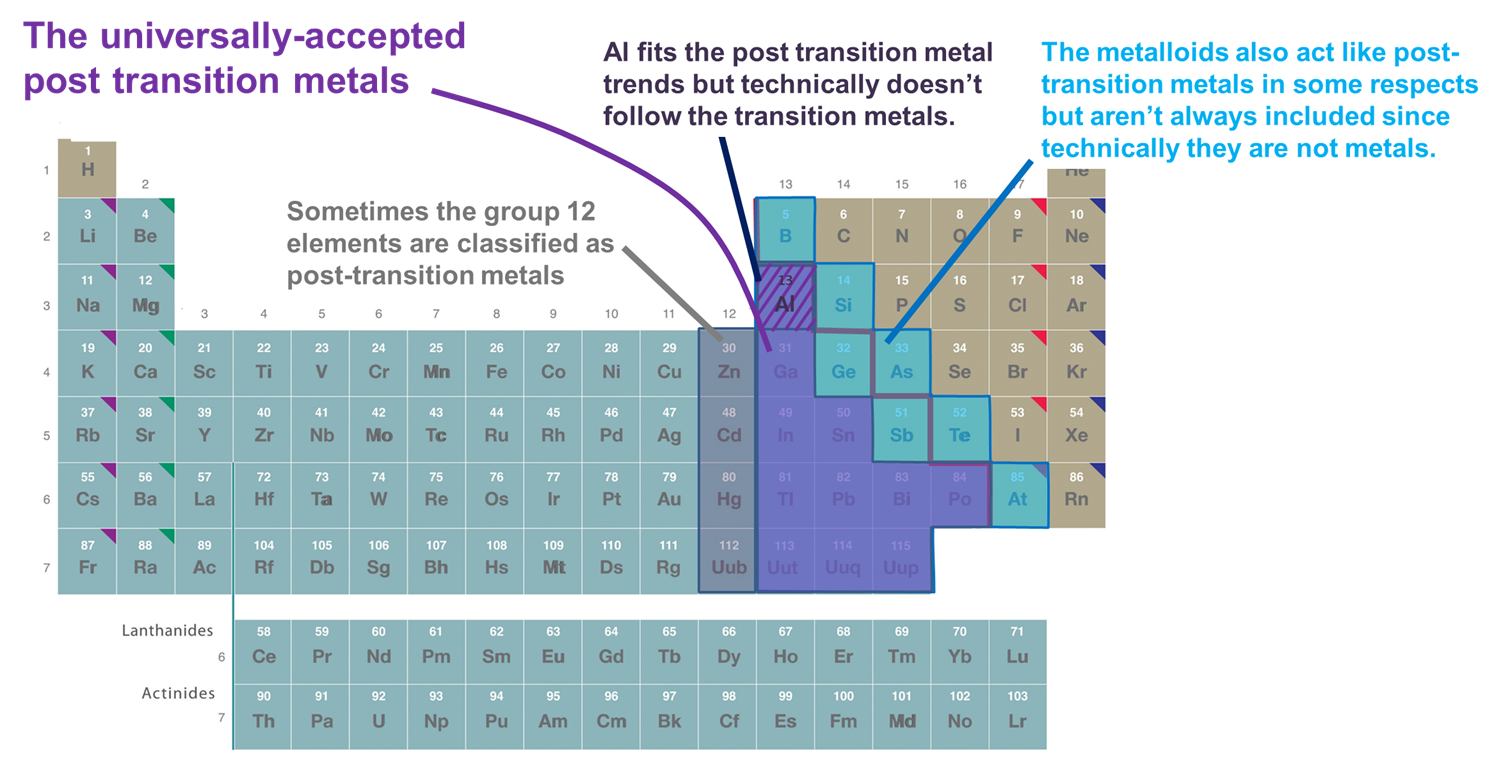
Rysunek ¨(¨sf{PageIndex{2}}). Niektóre z pierwiastków zaliczanych do metali postprzejściowych. Te pokazane w kolorze fioletowym są powszechnie akceptowane, ponieważ są metalami i wyraźnie podążają za metalami przejściowymi, podczas gdy metale z grupy 12 (i czasami 11), Al, i metaloidy są czasami uwzględniane, ponieważ zachowują się jak inne metale po przejściu w ważnych aspektach. Układ okresowy jest zaadaptowany z układu na stronie https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atomy%2C_Molekuły%2C_i_Iony/2.5%3A_The_Periodic_Table.
.
Dodaj komentarz