Evaporation
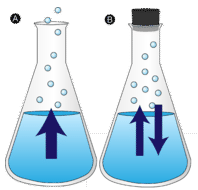
Kałuża wody pozostawiona bez zakłóceń w końcu znika. Cząsteczki cieczy przechodzą do fazy gazowej, stając się parą wodną. Parowanie jest procesem, w którym ciecz jest przekształcana w gaz. Odparowanie to przemiana cieczy w jej parę poniżej temperatury wrzenia cieczy. Jeśli zamiast tego woda jest przechowywana w zamkniętym pojemniku, cząsteczki pary wodnej nie mają szansy uciec do otoczenia i dlatego poziom wody nie zmienia się. Ponieważ niektóre cząsteczki wody stają się parą, taka sama liczba cząsteczek pary wodnej skrapla się z powrotem do stanu ciekłego. Kondensacja to zmiana stanu z gazowego na ciekły.
Aby cząsteczka cieczy mogła przejść w stan gazowy, musi mieć wystarczającą energię kinetyczną, aby pokonać międzycząsteczkowe siły przyciągania w cieczy. Przypomnijmy, że dana próbka cieczy będzie zawierać cząsteczki o szerokim zakresie energii kinetycznych. Cząsteczki cieczy, które mają pewną progową energię kinetyczną, uciekają z powierzchni i stają się parą. W rezultacie, cząsteczki cieczy, które pozostają, mają teraz niższą energię kinetyczną. W miarę odparowywania temperatura pozostałej cieczy spada. Zaobserwowałeś efekty chłodzenia wyparnego. W gorący dzień cząsteczki wody zawarte w pocie pochłaniają ciepło ciała i odparowują z powierzchni skóry. Proces parowania pozostawia pozostały pot chłodniejszy, który z kolei pochłania więcej ciepła z ciała.
Dana ciecz będzie parować szybciej, gdy jest podgrzewana. Dzieje się tak, ponieważ proces ogrzewania powoduje, że większa część cząsteczek cieczy ma niezbędną energię kinetyczną, aby uciec z powierzchni cieczy. Poniższy rysunek przedstawia rozkład energii kinetycznej cząsteczek cieczy w dwóch temperaturach. Liczby cząsteczek, które mają wymaganą energię kinetyczną do odparowania są pokazane w zacienionym obszarze pod krzywą po prawej stronie. Ciecz o wyższej temperaturze \(\ lewa( T_2 \ prawa)\) ma więcej cząsteczek, które są w stanie uciec do fazy pary niż ciecz o niższej temperaturze \(\ lewa( T_1 \ prawa)\).
Dodaj komentarz