Wiązanie w acetylenie
Wreszcie, koncepcja orbitali hybrydowych stosuje się dobrze do grup z potrójnym wiązaniem, takich jak alkiny i nitryle. Rozważmy, na przykład, strukturę etynu (potoczna nazwa acetylen), najprostszego alkinu.
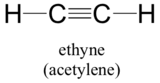
Ta cząsteczka jest liniowa: wszystkie cztery atomy leżą w linii prostej. Wiązanie potrójne węgiel-węgiel ma tylko 1,20Å długości. W hybrydowym obrazie orbitali acetylenu, oba węgle są sp-hybrydyzowane. W sp-hybrydyzowanym węglu, orbital 2s łączy się z orbitalem 2px tworząc dwa orbitale hybrydowe sp, które są zorientowane pod kątem 180° względem siebie (np. wzdłuż osi x). Orbitale 2py i 2pz pozostają niezhybrydyzowane i są zorientowane prostopadle odpowiednio wzdłuż osi y i z.


Wiązanie C-C sigma jest zatem tworzone przez nakładanie się jednego orbitali sp z każdego z węgli, podczas gdy dwa wiązania C-H sigma są tworzone przez nakładanie się drugiego orbitali sp na każdym z węgli z orbitalem 1s na wodorze. Każdy atom węgla posiada jeszcze dwa w połowie wypełnione orbitale 2py i 2pz, które są prostopadłe zarówno do siebie jak i do linii utworzonej przez wiązania sigma. Te dwie prostopadłe pary orbitali p tworzą dwa wiązania pi pomiędzy węglami, dając w sumie wiązanie potrójne (jedno wiązanie sigma plus dwa wiązania pi).

Koncepcja orbitali hybrydowych ładnie wyjaśnia inną obserwację eksperymentalną: wiązania pojedyncze sąsiadujące z wiązaniami podwójnymi i potrójnymi są stopniowo krótsze i silniejsze niż „normalne” wiązania pojedyncze, takie jak te w prostym alkanie. Wiązanie węgiel-węgiel w etanie (struktura A poniżej) wynika z nałożenia się dwóch orbitali sp3.

W alkanie B, jednakże, wiązanie pojedyncze węgiel-węgiel jest wynikiem nakładania się orbitali sp2 i sp3, podczas gdy w alkenie C wiązanie pojedyncze węgiel-węgiel jest wynikiem nakładania się orbitali sp i sp3. To wszystko są wiązania pojedyncze, ale wiązanie w cząsteczce C jest krótsze i silniejsze niż w B, które z kolei jest krótsze i silniejsze niż w A.
Wyjaśnienie jest tu stosunkowo proste. Orbital sp składa się z jednego orbitalu s i jednego orbitalu p, a więc ma 50% znaku s i 50% znaku p. Orbitale sp2, dla porównania, mają 33% znaku s i 67% znaku p, podczas gdy orbitale sp3 mają 25% znaku s i 75% znaku p. Ze względu na swój sferyczny kształt, orbitale 2s są mniejsze i trzymają elektrony bliżej i „ciaśniej” jądra, w porównaniu do orbitali 2p. W konsekwencji, wiązania z nakładaniem się sp + sp3 (jak w alkenie C) są krótsze i silniejsze niż wiązania z nakładaniem się sp2 + sp3 (jak w alkanie B). Wiązania z nakładaniem się sp3-sp3 (jak w alkanie A) są najdłuższe i najsłabsze z tej grupy, ze względu na 75% charakter „p” hybryd.
.
Dodaj komentarz