Czyste Substancje i Mieszaniny
Czysta substancja chemiczna to każda materia, która ma stały skład chemiczny i charakterystyczne właściwości. Tlen, na przykład, jest czystą substancją chemiczną, która jest bezbarwnym, bezwonnym gazem w temperaturze 25°C. Bardzo niewiele próbek materii składa się z czystych substancji; większość z nich to mieszaniny, które są kombinacjami dwóch lub więcej czystych substancji w zmiennych proporcjach, w których poszczególne substancje zachowują swoją tożsamość. Powietrze, woda z kranu, mleko, ser pleśniowy, chleb i brud są mieszaninami. Jeśli wszystkie części materiału są w tym samym stanie, nie mają widocznych granic i są jednorodne w całości, to materiał jest jednorodny. Przykładami mieszanin jednorodnych są powietrze, którym oddychamy i woda z kranu, którą pijemy. Mieszaniny jednorodne nazywane są również roztworami. Tak więc powietrze jest roztworem azotu, tlenu, pary wodnej, dwutlenku węgla i kilku innych gazów; woda z kranu jest roztworem niewielkich ilości kilku substancji w wodzie. Konkretny skład obu tych roztworów nie jest jednak stały, lecz zależy zarówno od źródła, jak i lokalizacji; na przykład, skład wody z kranu w Boise, Idaho, nie jest taki sam, jak skład wody z kranu w Buffalo, w stanie Nowy Jork. Chociaż większość roztworów, z którymi się spotykamy, jest płynna, roztwory mogą być również stałe. Szara substancja nadal używana przez niektórych dentystów do wypełniania ubytków w zębach jest złożonym roztworem stałym, który zawiera 50% rtęci i 50% proszku, który zawiera głównie srebro, cynę i miedź, z niewielkimi ilościami cynku i rtęci. Stałe roztwory dwóch lub więcej metali są powszechnie nazywane stopami.
Jeśli skład materiału nie jest całkowicie jednolity, to jest on heterogeniczny (np. ciasto czekoladowe, niebieski ser i brud). Mieszaniny, które wydają się być jednorodne, często okazują się niejednorodne po badaniu mikroskopowym. Na przykład mleko wydaje się być jednorodne, ale po zbadaniu pod mikroskopem wyraźnie widać, że składa się z drobnych kuleczek tłuszczu i białka rozproszonych w wodzie. Składniki mieszanin niejednorodnych można zazwyczaj rozdzielić za pomocą prostych środków. Mieszaniny ciała stałego i cieczy, takie jak piasek w wodzie czy liście herbaty w herbacie, łatwo rozdziela się przez filtrację, która polega na przepuszczeniu mieszaniny przez barierę, taką jak sitko, z otworami lub porami mniejszymi niż cząstki ciała stałego. W zasadzie mieszaniny dwóch lub więcej ciał stałych, takich jak cukier i sól, mogą być oddzielone przez mikroskopową kontrolę i sortowanie. Zazwyczaj jednak konieczne są bardziej złożone operacje, jak na przykład oddzielanie samorodków złota od żwiru rzecznego za pomocą panningu. Najpierw materiał stały jest filtrowany z wody rzecznej, a następnie oddzielany przez kontrolę. Jeśli złoto jest osadzone w skale, może być konieczne jego wyizolowanie metodami chemicznymi.
-and-Milk-(left).jpg?revision=1)
Rysunek 1.2.2: Mieszanina heterogeniczna. Pod mikroskopem mleko pełne jest w rzeczywistości heterogeniczną mieszaniną składającą się z kuleczek tłuszczu i białka rozproszonych w wodzie. Rysunek użyty za zgodą Wikipedii
Mieszaniny niejednorodne (roztwory) mogą być rozdzielone na substancje składowe w procesach fizycznych, które opierają się na różnicach w niektórych właściwościach fizycznych, takich jak różnice w ich punktach wrzenia. Dwie z tych metod rozdzielania to destylacja i krystalizacja. Destylacja wykorzystuje różnice w lotności, czyli miary łatwości, z jaką dana substancja przekształca się w gaz w danej temperaturze. Prosty aparat destylacyjny do rozdzielania mieszaniny substancji, z których co najmniej jedna jest cieczą. Najbardziej lotny składnik wrze jako pierwszy i jest skraplany z powrotem do postaci cieczy w chłodnicy chłodzonej wodą, z której spływa do kolby odbieralnika. Jeśli na przykład destyluje się roztwór soli i wody, bardziej lotny składnik, czysta woda, zbiera się w kolbie odbiorczej, podczas gdy sól pozostaje w kolbie destylacyjnej.

Rysunek 1.2.3: Destylacja roztworu soli kuchennej w wodzie. Roztwór soli w wodzie jest ogrzewany w kolbie destylacyjnej do momentu wrzenia. Powstała para jest wzbogacona w bardziej lotny składnik (wodę), który skrapla się do postaci cieczy w zimnym skraplaczu, a następnie jest zbierany w kolbie odbiorczej.
Mieszaniny dwóch lub więcej cieczy o różnych punktach wrzenia mogą być rozdzielane za pomocą bardziej złożonej aparatury destylacyjnej. Jednym z przykładów jest rafinacja ropy naftowej na szereg użytecznych produktów: paliwo lotnicze, benzynę, naftę, olej napędowy i olej smarowy (w przybliżonej kolejności malejącej lotności). Innym przykładem jest destylacja napojów alkoholowych, takich jak brandy czy whisky. Ta stosunkowo prosta procedura spowodowała więcej niż kilka bólów głowy dla władz federalnych w latach 20-tych w czasach prohibicji, kiedy nielegalne jeszcze mnożyły się w odległych regionach Stanów Zjednoczonych.
Krystalizacja oddziela mieszaniny w oparciu o różnice w rozpuszczalności, miara tego, ile substancji stałej pozostaje rozpuszczony w danej ilości określonej cieczy. Większość substancji jest bardziej rozpuszczalna w wyższych temperaturach, więc mieszanina dwóch lub więcej substancji może być rozpuszczona w podwyższonej temperaturze, a następnie pozostawiona do powolnego schłodzenia. Ewentualnie można pozwolić, aby ciecz, zwana rozpuszczalnikiem, odparowała. W obu przypadkach, najmniej rozpuszczalna z rozpuszczonych substancji, ta, która ma najmniejsze szanse pozostać w roztworze, zwykle tworzy kryształy jako pierwsza, a te kryształy mogą być usunięte z pozostałego roztworu przez filtrację.

Rysunek 1.2.4: Krystalizacja octanu sodu ze stężonego roztworu octanu sodu w wodzie. Dodanie małego „zalążka” kryształu (a) powoduje, że związek tworzy białe kryształy, które rosną i ostatecznie zajmują większość kolby. Film można znaleźć tutaj: https://www.youtube.com/watch?v=BLq5NibwV5g
Większość mieszanin można rozdzielić na czyste substancje, które mogą być albo pierwiastkami, albo związkami. Pierwiastek, taki jak szary, metaliczny sód, jest substancją, której nie można rozłożyć na prostsze w wyniku przemian chemicznych; związek, taki jak biały, krystaliczny chlorek sodu, zawiera dwa lub więcej pierwiastków i ma właściwości chemiczne i fizyczne, które zwykle różnią się od właściwości pierwiastków, z których się składa. Z nielicznymi wyjątkami, dany związek ma ten sam skład pierwiastkowy (te same pierwiastki w tych samych proporcjach), niezależnie od jego źródła lub historii. Skład chemiczny substancji ulega zmianie w procesie zwanym przemianą chemiczną. Przemiana dwóch lub więcej pierwiastków, takich jak sód i chlor, w związek chemiczny – chlorek sodu – jest przykładem przemiany chemicznej, często nazywanej reakcją chemiczną. Obecnie znanych jest około 115 pierwiastków, ale z tych 115 pierwiastków otrzymano miliony związków chemicznych. Znane pierwiastki są wymienione w układzie okresowym.
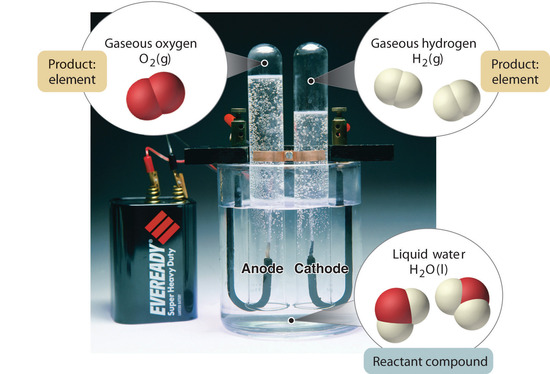
Rysunek 1.2.5: Rozkład wody na wodór i tlen w procesie elektrolizy. Woda jest związkiem chemicznym; wodór i tlen są pierwiastkami.
Ogólnie, odwrotny proces chemiczny rozkłada związki na ich pierwiastki. Na przykład, woda (związek) może być rozłożona na wodór i tlen (oba elementy) w procesie zwanym elektrolizą. W elektrolizie energia elektryczna dostarcza energii potrzebnej do rozdzielenia związku na jego elementy składowe (Rysunek 1.2.5). Podobna technika jest stosowana na szeroką skalę do otrzymywania czystego aluminium, pierwiastka, z jego rud, które są mieszaninami związków chemicznych. Ponieważ do elektrolizy potrzebna jest duża ilość energii, koszt energii elektrycznej jest zdecydowanie największym wydatkiem ponoszonym przy produkcji czystego aluminium. Dlatego recykling aluminium jest zarówno opłacalny, jak i ekologicznie uzasadniony. Ogólna organizacja materii i metody stosowane do rozdzielania mieszanin są podsumowane na rysunku 1.2.6.
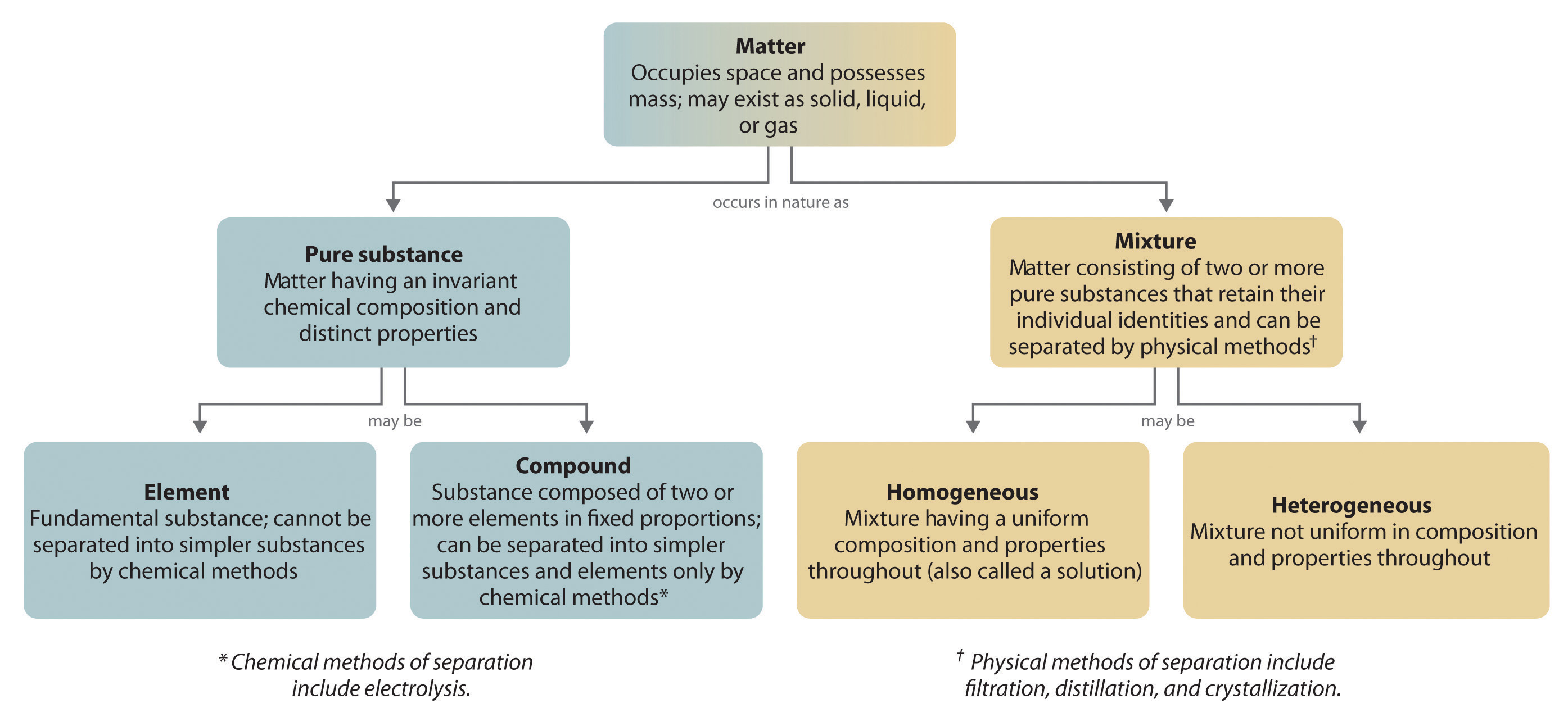
Rysunek 1.2.6: Zależności pomiędzy typami materii a metodami stosowanymi do rozdzielania mieszanin
Przykład 1.2.1
Zidentyfikuj każdą substancję jako związek, pierwiastek, mieszaninę niejednorodną lub mieszaninę jednorodną (roztwór).
- filtrowana herbata
- świeżo wyciśnięty sok pomarańczowy
- płyta kompaktowa
- tlenek glinu, biały proszek, który zawiera 2:3 stosunek atomów aluminium i tlenu
- selen
Dane: substancja chemiczna
Pytanie o: jej klasyfikacja
Strategia:
- Zdecyduj, czy substancja jest chemicznie czysta. Jeśli jest czysta, substancja jest albo pierwiastkiem, albo związkiem. Jeśli substancję można rozdzielić na jej elementy, jest ona związkiem.
- Jeśli substancja nie jest chemicznie czysta, jest ona albo mieszaniną heterogeniczną albo mieszaniną jednorodną. Jeśli jej skład jest jednolity w całej objętości, jest to mieszanina jednorodna.
Roztwór:
- Herbata jest roztworem związków w wodzie, więc nie jest chemicznie czysta. Zwykle oddziela się ją od liści herbaty przez filtrację. B Ponieważ skład roztworu jest jednolity, jest to mieszanina jednorodna.
- A Sok pomarańczowy zawiera cząstki stałe (miazgę) oraz ciecz; nie jest chemicznie czysty. B Ponieważ jego skład nie jest jednorodny w całości, sok pomarańczowy jest mieszaniną niejednorodną.
- A Płyta kompaktowa jest materiałem stałym, który zawiera więcej niż jeden pierwiastek, a wzdłuż jej krawędzi widoczne są obszary o różnym składzie. W związku z tym płyta kompaktowa nie jest chemicznie czysta. B Regiony o różnym składzie wskazują, że płyta kompaktowa jest mieszaniną heterogeniczną.
- A Tlenek glinu jest pojedynczym, chemicznie czystym związkiem.
- A Selen jest jednym ze znanych pierwiastków.
Ćwiczenie 1.2.1
Zidentyfikuj każdą substancję jako związek, pierwiastek, mieszaninę niejednorodną lub mieszaninę jednorodną (roztwór).
- białe wino
- merkurydza
- sos sałatkowy w stylu żurawinowym
- cukier stołowy (sacharoza)
Odpowiedź:
- roztwór
- element
- mieszanina niejednorodna
- składnik
Podsumowanie
Materię można sklasyfikować według właściwości fizycznych i chemicznych. Materia to wszystko, co zajmuje przestrzeń i ma masę. Trzy stany materii są stałe, ciekłe i gazowe. Zmiana fizyczna polega na przekształceniu substancji z jednego stanu materii w inny, bez zmiany jej składu chemicznego. Większość materii składa się z mieszanin czystych substancji, które mogą być homogeniczne (jednorodne w składzie) lub heterogeniczne (różne regiony mają różne składy i właściwości). Czyste substancje mogą być albo związkami chemicznymi, albo pierwiastkami. Związki chemiczne można rozłożyć na pierwiastki w wyniku reakcji chemicznych, ale pierwiastków nie można rozdzielić na prostsze substancje za pomocą środków chemicznych. Właściwości substancji można sklasyfikować jako fizyczne lub chemiczne. Naukowcy mogą obserwować właściwości fizyczne bez zmiany składu substancji, natomiast właściwości chemiczne opisują skłonność substancji do ulegania zmianom chemicznym (reakcjom chemicznym), które zmieniają jej skład chemiczny. Właściwości fizyczne mogą być intensywne lub ekstensywne. Intensywne właściwości są takie same dla wszystkich próbek; nie zależą od wielkości próbki; i obejmują, na przykład, kolor, stan fizyczny i temperatury topnienia i wrzenia. Właściwości ekstensywne zależą od ilości materiału i obejmują masę i objętość. Stosunek dwóch ekstensywnych właściwości, masy i objętości, jest ważną intensywną właściwością zwaną gęstością.
Współautorzy
Modyfikacja przez Joshua Halpern (Howard University)
.
Dodaj komentarz