- Che cos’è il ferro
- Dove si trova il ferro
- Storia
- Identificazione
- Classificazione, Proprietà e caratteristiche del ferro
- Proprietà generali
- Proprietà fisiche
- Proprietà chimiche
- Dati atomici del ferro (elemento 26)
- Quali sono gli usi comuni del ferro
- L’elemento ha effetti tossici
- Fatti interessanti
- Prezzo del metallo di ferro
Che cos’è il ferro
Il ferro (pronunciato come EYE-ren) è un metallo duro con un alto valore commerciale, appartenente alla famiglia dei metalli di transizione. Rappresentato dal simbolo chimico Fe, è chimicamente reattivo con una tendenza a corrodersi facilmente in aria formando uno strato rossastro chiamato ruggine quando esposto all’aria umida.

Simbolo del ferro
Dove si trova il ferro
È il quarto metallo più abbondante nella crosta terrestre, comunemente associato ad altri minerali come ematite, taconite e magnetite che si trovano nelle riserve minerarie di Ucraina, Brasile, Russia, Australia e Cina. La sua produzione commerciale viene effettuata in un altoforno riscaldando i minerali con coke e calcare.
Storia
Origine del suo nome: Il nome dell’elemento deriva da una parola anglosassone ‘iron’.
Chi lo ha scoperto: Sconosciuto
Quando, dove e come fu scoperto
Circa il 3500 a.C., si credeva che gli Egiziani usassero oggetti di ferro. Gli Ittiti dell’Asia Minore erano noti per fondere il metallo dai suoi minerali durante il 1500 a.C. Nel 1722, René Antoine Ferchault de Réaumur, un entomologo francese, pubblicò un libro che descriveva il significato delle diverse leghe di ferro.

Metallo ferro
Identificazione |
|||
| Numero atomico | 26 | ||
| Numero CAS | 7439-89-6 | ||
| Posizione nella tavola periodica | Gruppo | Periodo | Blocco |
| 8 | 4 | d | |
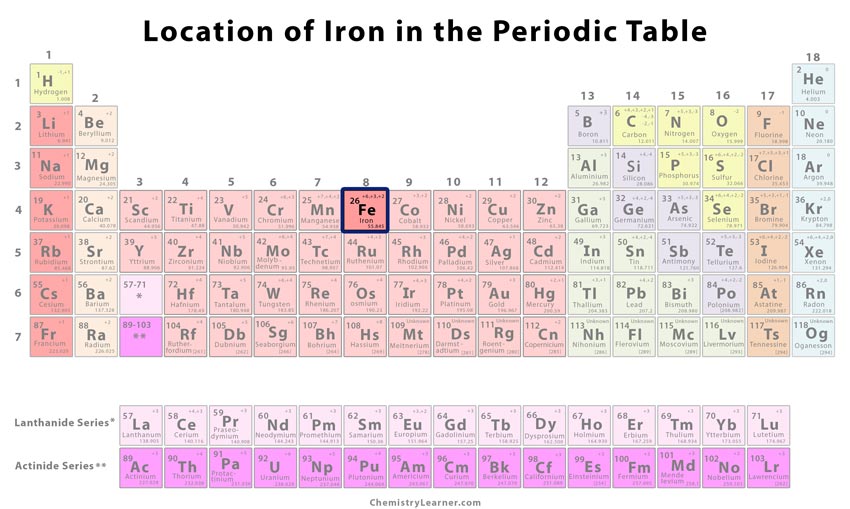
Dove si trova il ferro nella tavola periodica
Classificazione, Proprietà e caratteristiche del ferro
Proprietà generali |
||
| Massa atomica relativa | 55.845 | |
| Massa atomica/peso | 55.845 unità di massa atomica | |
| Massa molecolare/peso molecolare | 55.845 g/mole | |
| Numero di massa | 56 | |
Proprietà fisiche |
||
| Colore/aspetto fisico | Grigio argento | |
| Punto di fusione/punto di congelamento | 1538°C (2800°F) | |
| Punto di ebollizione | 2861°C (5182°F) | |
| Densità | 7.87 g/cm3 | |
| Standard/stato naturale a temperatura ambiente (solido/liquido/gas) | Solido | |
| Malleabilità | Sì | |
| Duttilità | Sì | |
| Durezza | 4-5 Mohs | |
| Capacità termica specifica | 0.444 J g-1 oC | |
| Conducibilità termica | 80.4 Wm-1K-1 | |
Proprietà chimiche |
||
| Infiammabilità | Non infiammabile | |
| Stato di ossidazione (numeri) | 6, 3, 2, 0,-2 | |
Dati atomici del ferro (elemento 26)
| Configurazione degli elettroni (configurazione dei gas nobili) | 3d64s2 | ||||||
| Struttura atomica | |||||||
| – Numero di elettroni | 26 | ||||||
| – Numero di neutroni | 30 | ||||||
| – Numero di Protoni | 26 | ||||||
| Raggio dell’atomo | |||||||
| – Raggio atomico | 2.04 Å | ||||||
| – Raggio covalente | 1.24 Å | ||||||
| – Energia di ionizzazione
(kJmol-1) |
1° | 2° | 3° | 4° | 5° | 6° | 7° |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
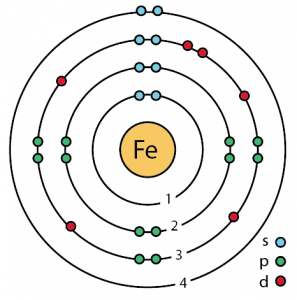
Struttura atomica del ferro (modello Bohr)
Quali sono gli usi comuni del ferro
- Il ferro è usato nella fabbricazione di diversi tipi di acciaio in lega con altri elementi come carbonio, nichel, cromo e tungsteno per la fabbricazione di attrezzature da taglio, catene di biciclette, canne di fucile, torri di trasmissione, travi di ponti e cemento armato.
- L’acciaio inossidabile che contiene un’alta percentuale di ferro insieme ad altri metalli ha un’enorme forza e una migliore funzione che è utile nella fabbricazione di strumenti chirurgici, graffette, posate, cuscinetti a sfera e gioielli.
- Un’altra forma di Fe chiamata ferro battuto ottenuta per fusione è usata per fare strumenti da carpentiere, ganci di sollevamento, catene, recinti e cancelli.
- I riempimenti di ferro sono applicabili in esperimenti di scienza elettromagnetismo per valutare la forza dei magneti così come in metallurgia di potenza, opere d’arte, fuochi d’artificio, e sabbiatura .
- Fe agisce come un catalizzatore efficiente è alcuni processi chimici industriali come il processo Haber e Fischer-Tropsch .

Barra di ferro
L’elemento ha effetti tossici
L’ingestione accidentale di Fe è stata associata a vomito, diarrea e altri problemi gastrointestinali, un tipo comune di avvelenamento da metalli. L’accumulo prolungato nel corpo potrebbe provocare problemi respiratori e disturbi cardiaci. L’inalazione della polvere metallica o dei fumi può causare una grave reazione polmonare.
Fatti interessanti
- Si ritiene che le meteoriti abbiano un alto contenuto di ferro.
- Il ferro era usato come metallo magnetico dagli antichi navigatori sotto forma di pietre di loden per la fabbricazione di bussole.
- In un corpo umano medio, sono presenti 4 grammi di Fe, associati all’emoglobina che a sua volta aiuta a trasportare ossigeno ai polmoni.
-

Polvere di ferro
Prezzo del metallo di ferro
Il costo del ferro puro può variare tra 0,24 e 0,30 dollari per libbra.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Lascia un commento