La struttura di Lewis dello ione carbonato è disegnata in questo tutorial passo dopo passo. Il concetto di elettroni di valenza totale è usato per disegnare la struttura di Lewis di CO32-. Dopo aver finito la struttura di lewis di CO32-, ci dovrebbe essere una carica -2 e una stabilità. Imparerai queste cose in questo tutorial.
- Ione carbonato | CO32-
- CO32- struttura di Lewis
- Passi per disegnare la struttura di Lewis di CO32-
- Numero totale di elettroni dei gusci di valenza di CO32-
- Totale coppie di elettroni di valenza
- Atomo centrale dello ione CO32-
- Coppie solitarie sugli atomi
- Cariche sugli atomi
- Controllare la stabilità e minimizzare le cariche sugli atomi convertendo le coppie solitarie in legami
- Struttura lewis dello ione CO32- (carbonato)
- Struttura lewis del carbonato e struttura lewis del bicarbonato
Ione carbonato | CO32-
Lo ione carbonato ha una carica -2. I composti di carbonato di metallo sono comuni nel mondo. Come CaCO3 può essere dato.
CO32- struttura di Lewis
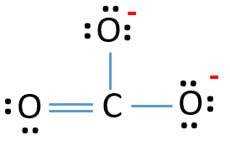
Ci sono tre legami σ e un legame π intorno all’atomo di carbonio nella struttura di Lewis dello ione CO32-.
Passi per disegnare la struttura di Lewis di CO32-
I seguenti passi sono necessari per disegnare la struttura di CO32- lewis e sono spiegati in dettaglio in questo tutorial.
- Trova il numero totale di elettroni dei gusci di valenza degli atomi di carbonio e di ossigeno
- Totale coppie di elettroni
- Selezione dell’atomo centrale
- Mettere coppie solitarie sugli atomi
- Verificare la stabilità e minimizzare le cariche sugli atomi convertendo le coppie solitarie in legami.
Disegnare la corretta struttura di lewis è importante per disegnare correttamente le strutture di risonanza di CO32-.
Numero totale di elettroni dei gusci di valenza di CO32-
Il carbonio si trova nel gruppo 4 della tavola periodica. Quindi, il carbonio ha quattro elettroni nel suo guscio di valenza. Ha sei elettroni nel guscio di valenza.
- Totale elettroni di valenza dati dall’atomo di carbonio = 4
Ci sono tre atomi di ossigeno nello ione CO32-, quindi
- Totale elettroni di valenza dati dagli atomi di ossigeno = 6 *3 = 18
Ci sono -2 cariche sullo ione CO32-. Quindi ci sono due elettroni in più che contribuiscono agli elettroni di valenza.
- Totale elettroni di valenza = 4 + 18 + 2 = 24
Totale coppie di elettroni di valenza
Totale coppie di elettroni di valenza = σ legami + π legami + coppie solitarie nei gusci di valenza
Le coppie di elettroni totali sono determinate dividendo il numero totale di elettroni di valenza per due. Per lo ione CO32-, le coppie totali di elettroni sono 12.
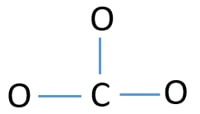
Atomo centrale dello ione CO32-
Per essere l’atomo centrale, è importante la capacità di avere una valenza più alta. Il carbonio ha più possibilità di essere l’atomo centrale (vedi la figura) perché il carbonio può mostrare una valenza di 4. La valenza più alta dell’ossigeno è 2. Quindi, ora possiamo costruire uno schizzo dello ione CO32-.
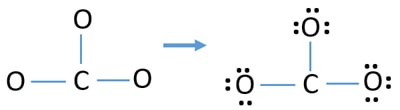
Coppie solitarie sugli atomi
- Ci sono già tre legami C-O nello schizzo precedente. Quindi rimangono solo nove (12-3 = 9) coppie di elettroni di valenza.
- Prima di tutto, segnate quelle nove coppie di elettroni di valenza come coppie solitarie in atomi esterni (su atomi di ossigeno). Un atomo di ossigeno prenderà tre coppie solitarie seguendo la regola ottale (l’atomo di ossigeno non può mantenere più di otto elettroni nel suo guscio di valenza).
- Per tre atomi di ossigeno, nove coppie di elettroni sono spese. Ora non ci sono più coppie solitarie da marcare sugli atomi di carbonio dopo aver marcato gli atomi di ossigeno (fuori dagli atomi).
Cariche sugli atomi
Dopo aver marcato le coppie di elettroni sugli atomi, dobbiamo marcare le cariche di ogni atomo. La marcatura delle cariche è significativa perché serve a determinare la migliore struttura di lewis dello ione. Dopo aver segnato le cariche, vedrete, ogni atomo di ossigeno otterrà una carica -1 e l’atomo di carbonio otterrà una carica +1.
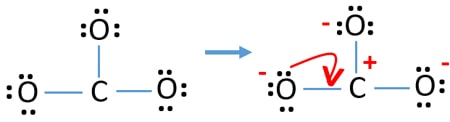
Controllare la stabilità e minimizzare le cariche sugli atomi convertendo le coppie solitarie in legami
- Gli atomi di ossigeno dovrebbero tenere cariche negative perché l’elettronegatività dell’atomo di ossigeno è superiore all’atomo di carbonio. Altrimenti, possiamo dire che la capacità di trattenere le cariche negative è maggiore negli atomi di ossigeno che in quelli di carbonio.
- La struttura disegnata non è stabile perché tutti gli atomi hanno una carica (la struttura di Lewis dovrebbe essere stabile con meno cariche).
- Ora, dovremmo cercare di minimizzare le cariche convertendo le coppie solitarie in legami. Quindi convertire una coppia solitaria di un atomo di ossigeno per fare un legame C-O.
- Ora c’è un doppio legame tra l’atomo di carbonio e un atomo di ossigeno (un legame C=O). Ora, ci sono due legami singoli tra l’atomo di carbonio e altri due atomi di ossigeno (due legami C-O).
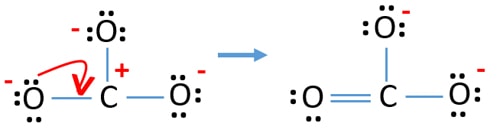
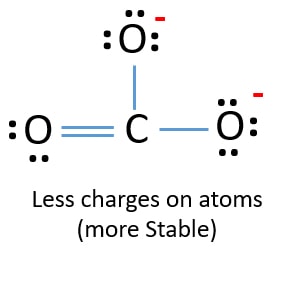
Nella nuova struttura, le cariche degli atomi sono ridotte rispetto alla struttura precedente. Ora non ci sono cariche su un atomo di ossigeno e sull’atomo di carbonio. Inoltre, solo due atomi di ossigeno hanno -1 carica negativa. Ora capisci che questa struttura di CO32- è più stabile della struttura precedente. Quindi, questa struttura ha più possibilità di essere la struttura di Lewis dello ione CO32-.
Struttura lewis dello ione CO32- (carbonato)
Domande
Fai le tue domande di chimica e trova le risposte
Struttura lewis del carbonato e struttura lewis del bicarbonato
Nello ione carbonato, ci sono due atomi di ossigeno che hanno -1 carica su ciascuno di essi. Uno di questi atomi di ossigeno prende un protone (ione H+) e forma un gruppo -OH.
Tutorial correlati
.
Lascia un commento