Ben Valsler
Tutto ciò che luccica non è oro,
lo avete sentito dire spesso.
Brian Clegg mostra un altro lato,
all’oro degli sciocchi – il solfuro di ferro.
Brian Clegg
“C’è oro in quelle colline! O c’è? Come suggerisce il suo soprannome di oro degli sciocchi, la forma minerale di pirite del disolfuro di ferro II ha più di una somiglianza passeggera con il metallo prezioso. Con la formula semplice FeS2, la struttura cubica del composto può portare alla produzione di forme platoniche dall’aspetto molto efficace, sia in cubi dai bordi netti che in dodecaedri che sembrano essere stati fabbricati, anche se più spesso la formazione naturale risulta in una struttura meno chiaramente delineata.

Fonte: ©
Nei cristalli di disolfuro di ferro, gli atomi di zolfo sono in coppia, con uno dei quattro legami dello zolfo legato ad un altro atomo di zolfo. Questi legami sono rotti sotto riscaldamento per produrre solfuro di ferro II – FeS – e zolfo. Questo processo è usato nella produzione di anidride solforosa, sia per usare il gas, per esempio come candeggina per la carta, sia come primo passo per produrre acido solforico. Più recentemente, il composto, che è un semiconduttore, ha trovato un uso nelle batterie al litio-ferro, dove il catodo è fatto di disolfuro di ferro: queste batterie sono compatibili in tensione con le tradizionali celle da 1,5 volt, ma durano molto di più delle equivalenti alcaline.

Fonte: ©
Forse la prima applicazione del disolfuro di ferro fu come alternativa alla pietra focaia per fare scintille – da cui il nome pirite – e fu spesso usato in questo modo nelle prime pistole. È stato anche usato a lungo nella produzione di solfato di ferro, tradizionalmente conosciuto come vetriolo verde. Il disolfuro di ferro è ancora usato a volte in questo modo, anche se con meccanismi più sofisticati rispetto all’approccio tradizionale di lasciare un mucchio di pirite fuori sotto la pioggia e raccogliere il liquido che gocciolava da esso.
Quando il minerale si ossida, emette una discreta quantità di calore, che può provocare esplosioni nelle miniere di carbone con un alto contenuto di zolfo. Questa tendenza ad ossidarsi non significa, tuttavia, che il disolfuro di ferro II sia sempre rinchiuso. La pirite levigata è stata usata in gioielleria fin dall’antichità e i suoi cristalli piuttosto scuri (raramente hanno la lucentezza dell’oro) erano particolarmente di moda tra la fine del 1700 e l’inizio del XX secolo.

Fonte: ©
Marcasite broach
Confusamente, i gioielli fatti dalla pirite sono chiamati gioielli di marcasite – confusi perché c’è un minerale alternativo di ferro II disolfuro chiamato marcasite, dove la struttura cubica è allungata in quella che è conosciuta come una forma ortorombica. Questa forma è meno adatta per fare pietre preziose perché è più fragile e rischia di sbriciolarsi. Il nome del gioiello (spesso pronunciato ‘marca-seet’ nel Regno Unito) risale al tempo in cui tutte le forme del minerale erano conosciute come marcasite.

Fonte: ©
Marcasite minerale
Tuttavia, il disolfuro di ferro II non è affatto l’unico modo per combinare ferro e zolfo. Il solfuro di ferro II, dall’aspetto molto meno attraente, è una sostanza a chiazze nere con una struttura ottaedrica intorno al ferro. Il composto si forma abbastanza frequentemente dalla decomposizione di materiale organico, sia come fango nero nelle paludi o la decolorazione scura di un tuorlo d’uovo troppo cotto.
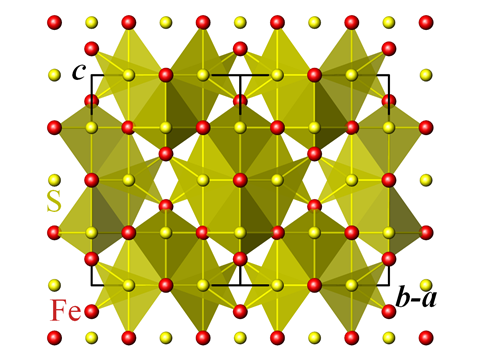
Fonte: Perditax
Struttura cristallina della greigite
Questo è solo l’inizio per le sottili varianti del solfuro di ferro. I minerali conosciuti come greigite, mackinawite e pirrotite hanno varianti della struttura, mentre la polvere nera del solfuro di ferro III – Fe2S3 – è stata prodotta solo artificialmente. La greigite è presente nelle abilità di un gruppo di batteri marini scoperti solo nel 1975 che hanno la notevole capacità di orientarsi secondo il campo magnetico terrestre. Chiamati batteri ‘magnetotattici’, questi organismi hanno cristalli nelle loro cellule che sono per lo più greigite, che è l’equivalente in solfuro di ferro del più noto materiale magnetico naturale, l’ossido di ferro magnetite.

Fonte: Raymond T. Downward, NASA
Superficie incisa del meteorite Mundrabilla, che mostra una fase metallica in lega ferro-nichel di kamcite (38% Ni) e taenite (6% Ni) in basso a destra, in basso a sinistra e in alto a sinistra. Il materiale più scuro è un solfuro di ferro (FeS o troilite) con un precipitato parallelo di duabreelite (solfuro di ferro-cromo (FeCr2S4).
Forse la più interessante delle strutture alternative è la troilite, un’altra forma di solfuro di ferro con una struttura esagonale. Sebbene si trovi occasionalmente sulla Terra, si trova più frequentemente nei meteoriti – in particolare le varietà relativamente poco comuni che hanno avuto origine sulla Luna e su Marte prima di essere spazzate via dalla superficie in un impatto dallo spazio.

Il nome troilite fu dato in onore del sacerdote italiano Domenico Troili che fece la prima osservazione registrata di una meteora con conseguente oggetto che colpì il suolo nel 1766. Troili pensava che il materiale principale del meteorite fosse la marcasite (probabilmente significa pirite), ma quasi 100 anni dopo il mineralogista tedesco Gustav Rose identificò la composizione del meteorite come un diverso solfuro di ferro e lo chiamò come Troili.
Il solfuro di ferro può essere un dolore. Può accumularsi, per esempio, nei pozzi di petrolio e di gas, impellicciando i tubi. Tuttavia, altrove ha dimostrato il suo valore. Può essere un semplice composto di due elementi chimici semplici, e come la pirite un falso oro ingannevole, ma nelle sue varie forme mostra una diversità e adattabilità che rende i suoi utenti tutt’altro che sciocchi.
Ben Valsler
Questo era Brian Clegg in difesa del solfuro di ferro. La prossima settimana, Mike Freemantle con il kerosene, e una forma non convenzionale di guerra.
Michael Freemantle
Circa un mese dopo l’attacco giapponese a Pearl Harbor nel dicembre 1941, un dentista americano escogitò un piano per demolire le città giapponesi legando piccole bombe incendiarie ai pipistrelli.
Ben Valsler
Scopri cosa accadde nel Progetto X-ray la prossima volta. Fino ad allora, potete mandare un’email a [email protected] o twittare @chemistryworld se avete richieste di composti che dovremmo includere nel podcast. Sono Ben Valsler, grazie per esserti unito a me.
Lascia un commento