Introduzione
L’embolia polmonare (PE) è una malattia comune con un’incidenza annuale di 110 casi su 100.000 adulti,1 in aumento negli ultimi anni.1,2 I sintomi possono variare, da quelli asintomatici allo shock ostruttivo dopo il collasso circolatorio.3 La mortalità complessiva non solo è alta, ma anche molto variabile. In uno studio recente, la mortalità complessiva è stata dell’8,65% a tre mesi.4 Le arterie centrali sono più comunemente coinvolte,5,6 mentre l’EP subsegmentale rappresenta il 4-7% dei casi.7-9 Tuttavia, alcuni studi riportano un coinvolgimento subsegmentale fino al 30% dei pazienti.9
La rilevanza clinica dell’estensione dell’EP è ancora discutibile, e il ruolo dell’anticoagulazione nei pazienti con coinvolgimento subsegmentale è stato contestato in diversi studi.10,11
L’obiettivo del nostro studio è stato quello di descrivere i particolari clinici dei pazienti con PE nel nostro ospedale e di analizzare la loro prognosi in base all’estensione della malattia.
Metodi
Abbiamo condotto uno studio retrospettivo di tutti i pazienti di età superiore ai 18 anni con diagnosi confermata di PE12 alla TAC del torace presso il complesso ospedaliero di Pontevedra in Spagna tra gennaio 2005 e dicembre 2010. Il follow-up è terminato il 31 gennaio 2012, termine ultimo di sopravvivenza. Pertanto, il follow-up minimo è stato di 14 mesi. I dati amministrativi delle dimissioni ospedaliere codificate sono stati utilizzati per la selezione dei pazienti. I pazienti con dati incompleti e/o diagnosi fatta con metodi diversi dalla TAC del torace sono stati esclusi dal campione iniziale di 470 pazienti. Così, 313 casi sono stati inclusi nello studio.
Sono stati analizzati i seguenti dati:
-
Dettagli personali: età, sesso, fumo attivo e obesità (indice di massa corporea >30).
-
Dati clinici, esame fisico e test supplementari: chirurgia recente, anestesia, trauma, cancro, viaggi prolungati e/o immobilizzazione; paralisi degli arti inferiori; inserimento di catetere centrale, trombofilia o sindrome antifosfolipidica; precedente malattia tromboembolica venosa (TEV); vene varicose degli arti inferiori; gravidanza, contraccezione o terapia ormonale. Tachipnea, rantolo crepitante, segni di DVT agli arti inferiori; segni vitali, ipotensione sistolica (SBP
100mmHg), ipotensione diastolica (DBP60mmHg) e tachicardia (frequenza cardiaca>100).13,14 Analisi dei gas del sangue arterioso, emoglobina, ematocrito, conta delle piastrine, leucocitosi, neutrofilia, glucosio, urea, creatinina, sodio, potassio e fibrinogeno, stratificati come normali o anormali secondo i valori di riferimento di laboratorio del nostro ospedale. I livelli di D-dimero sono stati determinati con un test immunologico turbidimetrico ad alta sensibilità. I livelli di D-dimero superiori a 500ng/ml sono stati considerati patologici. La funzione renale è stata considerata normale con una velocità di filtrazione glomerulare secondo l’equazione abbreviata MDRD superiore a 60ml/min/1.73m2.15 Risultati elettrocardiografici e di imaging: radiografia del torace semplice; l’eco-Doppler degli arti inferiori (completo o distale) è stato eseguito a discrezione del radiologo, in base alla presentazione clinica del paziente. I PE sono stati raccolti e classificati in tre gruppi con la TAC del torace: centrale (tronco principale, arteria polmonare destra o sinistra, arterie intermedie o arterie lobari), segmentale e subsegmentale. La posizione del trombo è stata determinata in base all’arteria più grande coinvolta. Comorbidità misurata dall’indice Charlson (CCI), categorizzata in “0”, “1-2” e “≥3”.16
La probabilità clinica è stata determinata con i punteggi di Wells17 e Ginevra18.
La causa della morte è stata attribuita dallo sperimentatore principale sulla base delle cartelle cliniche disponibili e categorizzata in tre gruppi: PE-correlata, PE-non-correlata, e sconosciuta. La discordanza tra i dati e le diagnosi finali incerte è stata risolta tramite discussione con i raccoglitori di dati.
Analisi statistica
I dati delle variabili categoriche sono presentati come frequenze (percentuali); i dati delle variabili continue sono presentati come mediane e intervalli interquartili.
I test esatti di Fisher e Chi-quadrato sono stati utilizzati per confrontare le variabili categoriche. Tra i gruppi, le variabili continue sono state confrontate tramite ANOVA o il test Kruskal-Wallis con distribuzioni non normali.
Le curve di sopravvivenza e gli aumenti di probabilità di morte sono stati calcolati rispettivamente con il test di Kaplan-Meier e la regressione di Cox. Le differenze sono state considerate significative a p
0,05. I dati sono stati analizzati con SPSS 15 per Windows.Risultati
Lo studio ha incluso 313 pazienti con PE; il 56% erano donne e l’età mediana era di 70 anni (range interquartile 53-78 anni). L’EP centrale ha rappresentato il 68% dei casi; l’EP segmentale e subsegmentale il 25% e il 7%. I pazienti con PE subsegmentale erano più giovani, avevano meno comorbidità e nessuno di loro presentava TVP prossimale (tabella 1). I pazienti del gruppo PE subsegmentale includevano 10 (45%) con PE singolo e 12 (55%) con PE multiplo.
Per quanto riguarda i sintomi, la dispnea è la più comune nei pazienti con PE centrale, e anche il dolore è comune nel PE segmentale e subsegmentale (Tabella 1). La comorbilità misurata tramite CCI era presente nel 78% dei casi, ed era più frequente nell’EP centrale (Tabella 1). Il 22% dei pazienti aveva ricevuto una diagnosi di cancro prima dell’EP (dati non mostrati). Per quanto riguarda la presenza di fattori di rischio e la probabilità clinica di PE secondo i punteggi di Wells e Ginevra, non sono state trovate differenze sull’estensione della malattia (Tabella 1). Per quanto riguarda i test supplementari, i pazienti con coinvolgimento dell’arteria centrale hanno mostrato valori di D-dimero significativamente più alti e hanno ottenuto risultati peggiori nell’analisi dei gas sanguigni. Nessuna differenza significativa è stata trovata in nessuno dei restanti parametri (Tabella 2). Tutti i pazienti sono stati ricoverati in ospedale e trattati con anticoagulanti.
La mortalità a 30 giorni è stata del 7%, attribuibile a PE nel 3,5% dei casi. I pazienti con PE subsegmentale hanno mostrato tassi di sopravvivenza significativamente più alti sia a 30 giorni che alla fine del follow-up (Fig. 1). Nessuna differenza è stata osservata nella causa di morte in base all’estensione dell’EP (Fig. 2). I fattori indipendentemente correlati a una maggiore probabilità di mortalità erano la diagnosi di cancro e una maggiore comorbidità misurata dall’indice di Charlson (Tabella 3).
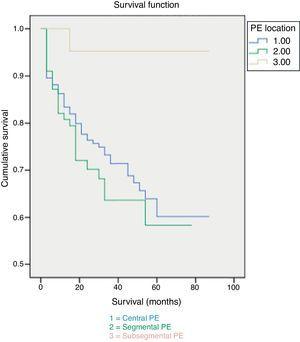
Tassi totali di sopravvivenza ed estensione della PE.

Cause di morte ed estensione della PE.
Predittori di mortalità. Analisi multivariata.
| Fattori | OR | CI 95% |
|---|---|---|
| PE posizione | ||
| Centrale | 1 | |
| Segmentale | 1.28 | 0.79-2.09 |
| Subsegmentale | 0.29 | 0.03-2.23 |
| Cancro | ||
| No | 1 | |
| Sì | 3.72 | 2.30-6.03 |
| Charlson | ||
| 0 | 1 | |
| 1-2 | 2.81 | 0.82-9.59 |
| ≥3 | 8.61 | 2.58-28.69 |
Adeguato per età, sesso, funzione renale e parametri dei gas sanguigni.
Discorso
La prevalenza di PE subsegmentale era del 7%, simile a quella riportata da altri autori.5 Nessuna differenza significativa di genere è stata trovata in termini di estensione della malattia; tuttavia, la percentuale di donne è leggermente più alta nel nostro campione. L’età dei pazienti con PE subsegmentale era inferiore a quella dei pazienti con PE centrale e segmentale. La differenza potrebbe essere legata all’ipercoagulazione e ai cambiamenti nell’endotelio vascolare che avvengono con l’invecchiamento19: questi potrebbero facilitare l’estensione dei trombi nei pazienti più anziani, soprattutto considerando che non è stata trovata alcuna differenza di età nella prevalenza dei fattori di rischio per l’EP.
Anche se i sintomi dell’EP sono aspecifici e la presentazione è solitamente simile negli adulti, abbiamo trovato dolore al petto nei pazienti più giovani e un’associazione positiva tra età e dispnea.19 Nel nostro studio, il dolore toracico nei pazienti più giovani con PE periferica e la dispnea nei pazienti più anziani con PE centrale e livelli più elevati di ipossia sono stati riportati più spesso. In generale, la dispnea si è verificata meno frequentemente nei pazienti con EP subsegmentale.10 Questi hanno ottenuto risultati migliori nell’analisi dei gas sanguigni e hanno avuto una presentazione clinica complessivamente meno grave,20 compresa una DVT prossimale inferiore.5,10
I livelli di D-dimero nei pazienti con EP sembrano essere associati alle dimensioni del trombo, sono correlati alla gravità dell’EP e hanno valore come marker prognostico.21 Abbiamo trovato livelli sierici inferiori nei pazienti con EP subsegmentale, che avevano una presentazione clinica più benigna e un esito migliore a medio termine. Tuttavia, il test del D-dimero è stato effettuato solo nel 30% dei casi. Pertanto, i nostri risultati non sono conclusivi.
Nel nostro studio, la mortalità a 30 giorni è stata più alta che in altri studi,22 anche se la percentuale di decessi legati all’EP era simile.4 Nessuno dei pazienti è morto a causa dell’EP subsegmentale. Le differenze nella mortalità potrebbero essere dovute a diverse cause: l’età media dei nostri pazienti è più alta, molti hanno malattie croniche di accompagnamento che possono condizionare il cattivo esito dell’EP, e anche il numero di morti per comorbidità è elevato. Infatti, il più importante fattore determinante della mortalità è la comorbidità, specialmente il cancro. I pazienti con cancro ed EP non solo hanno una cattiva prognosi, ma anche una prognosi peggiore rispetto ai pazienti con solo il cancro o l’EP.23 I sintomi dell’EP potrebbero essere scambiati con quelli delle esacerbazioni di precedenti malattie cardiopolmonari,24 portando a diagnosi e trattamento ritardati, prognosi peggiore e maggiore mortalità. I pazienti più anziani sono più complessi e possono avere una maggiore comorbidità e una diagnosi ritardata24; la comorbidità è stata anche suggerita come un fattore di rischio per l’EP in questi pazienti.25,26
Il significato clinico dell’EP subsegmentale è sconosciuto. Tuttavia, può avere rilevanza clinica e conseguenze a lungo termine in pazienti con bassa riserva cardiopolmonare.2 Di solito ha una bassa mortalità2,27 e una buona prognosi.5,28 Pertanto, alcuni autori hanno suggerito che alcuni pazienti non richiederebbero una terapia anticoagulante.29,30
I nostri dati suggeriscono che i pazienti con PE subsegmentale differiscono clinicamente in larga misura da quelli con PE più prossimale. La prognosi è influenzata dalla presenza di disturbi di accompagnamento piuttosto che dall’estensione della malattia.
Disposizioni eticheProtezione dei soggetti umani e animali
Gli autori dichiarano che le procedure seguite erano conformi alle norme del comitato etico della ricerca clinica pertinente e a quelle del codice etico dell’Associazione Medica Mondiale (Dichiarazione di Helsinki).
Confidenzialità dei dati
Gli autori dichiarano di aver seguito i protocolli del loro centro di lavoro sulla pubblicazione dei dati dei pazienti e che tutti i pazienti inclusi nello studio hanno ricevuto informazioni sufficienti e hanno dato il loro consenso informato scritto a partecipare allo studio.
Diritto alla privacy e consenso informato
Lascia un commento