ORIGINAL PAPERS
Rilevazione dell’antigene di superficie dell’epatite B utilizzando sieri in pool. Un’analisi costi-benefici
E. Fernández, L. Rodrigo1, S. García, S. Riestra1 e C. Blanco
Servizio di Biochimica. Ospedale de Cabueñes. Gijón. 1Servizio di Gastroenterologia. Ospedale Centrale de Asturias. Oviedo. Spagna
Corrispondenza
ABSTRACT
Obiettivi: esaminare la fattibilità ed eseguire un’analisi costi-benefici di una strategia di pooling di 5 campioni utilizzando un test immunoenzimatico (EIA) per lo screening dell’antigene di superficie dell’epatite B (HBsAg).
Materiale e metodi: per valutare la sensibilità e la specificità del metodo di pooling, ciascuno dei 40 sieri positivi (da debolmente a intensamente HBsAg-positivi) e 250 sieri negativi sono stati testati in un pool con 4 sieri HBsAg-negativi. Il limite di rilevamento per HBsAg/ad e HBsAg/ay è stato valutato utilizzando i sieri di un pannello di sottotipi purificati. Uno studio in condizioni reali è stato condotto utilizzando i pool di 340 donne incinte.
Risultati: la sensibilità e la specificità di questa tecnica erano del 100%. Il coefficiente di correlazione tra i rapporti campione/cutoff di 40 campioni studiati in condizioni singole e in pool è stato di 0,792 (p < 0,005). Il metodo pooling ha livelli di rilevazione inferiori per HBsAg/ad e HBsAg/ay a 0,20 ng/mL e 0,12 ng/mL, e il metodo singolo a 0,34 ng/mL e 0,29 ng/mL, rispettivamente. Il metodo di raggruppamento non perde sensibilità per valori fino a 100 IU/L di anti-HBs nei quattro sieri mescolati con un siero positivo. L’analisi costi-benefici ha dimostrato che il metodo del pooling potrebbe far risparmiare dal 30% al 75% del costo della determinazione dell’HBsAg, a seconda che le sieroprevalenze siano del 10% o dell’1%, rispettivamente.
Conclusioni: il pooling dell’HBsAg EIA non ha dato risultati peggiori del singolo test EIA, ed è stata una strategia valida ed economicamente vantaggiosa in aree con una prevalenza alta, media o bassa.
Parole chiave: Antigene di superficie dell’epatite B. Pooling dei sieri. Analisi costi-benefici.
Rodrigo L, Fernández E, García S, Riestra S, Blanco C. Individuazione dell’antigene di superficie dell’epatite B utilizzando sieri in pool. Un’analisi costi-benefici. Rev Esp Enferm Dig 2006; 98: 112-121.
Introduzione
L’infezione da virus dell’epatite B (HBV) è una malattia che colpisce milioni di persone nel mondo. Il suo principale serbatoio è quello dei portatori cronici di HBV. Si stima che circa 300 milioni di persone nel mondo siano infettate da questo virus (1). Le conseguenze mediche dell’infezione da HBV sono variabili e imprevedibili, a seconda di fattori quali l’età del paziente e lo stato immunitario. L’HBV è un agente eziologico ben riconosciuto per l’epatite cronica, la cirrosi epatica e il carcinoma epatocellulare.
Esistono tuttavia grandi differenze nella prevalenza dell’infezione, e questo ha portato alla definizione di tre aree principali di alta, media e bassa endemicità (2). Nella maggior parte dei paesi sviluppati, la prevalenza di portatori cronici di HBV è inferiore al 2% e la trasmissione dell’infezione avviene soprattutto negli adulti appartenenti a determinati gruppi a rischio (tossicodipendenti, uomini omosessuali, eterosessuali promiscui, operatori sanitari) (3). In Spagna è stata riscontrata una prevalenza dell’1,2% di portatori di HBV (4), e l’identificazione dell’HBsAg nei donatori di sangue, nelle donne incinte e nei soggetti sottoposti a programmi di autotrasfusione è obbligatoria.
La tecnica del pooling del siero cerca di ridurre i costi senza perdere efficacia, ed è stata utilizzata principalmente nei paesi in via di sviluppo nella ricerca di anticorpi contro il virus dell’immunodeficienza umana (HIV) (5-14), e il virus dell’epatite C (HCV) (15-19). I risultati ottenuti con questo metodo si sono dimostrati molto promettenti, in quanto hanno diminuito significativamente il costo dei test di laboratorio senza diminuire significativamente la loro sensibilità.
Il presente studio cerca di valutare se la tecnica del pooling del siero è applicabile nella ricerca dell’HBsAg per chiarire i fattori che possono modificare la sua sensibilità, e di eseguire un’analisi costi-benefici per questa tecnica diagnostica.
Materiale e metodi
Determinazione dell’HBsAg
Per la valutazione dell’HBsAg è stato utilizzato il saggio Imx HBsAg (Abbott Laboratories, Abbott Park, IL), un saggio immunoenzimatico (EIA) qualitativo su microparticelle di terza generazione. La presenza o l’assenza di HBsAg viene determinata confrontando il tasso di formazione del prodotto fluorescente con un cutoff, che viene calcolato dal tasso del calibratore negativo (N) (plasma umano non reattivo per HBsAg). Il saggio Imx HBsAg calcola un rapporto tra il tasso del campione (S) e il tasso del calibratore negativo. Il valore di cutoff (S/N) è stato stabilito a 2 per l’EIA monosiero.
La tecnica di pooling viene eseguita aggiungendo 200 mcL al pool, ovvero ottenendo una miscela di 40 mcL di ciascuno dei 5 sieri che compongono il pool (diluizione 1/5). Il cutoff è stato stabilito come la media dei campioni negativi più 3 deviazioni standard, ottenendo così un valore di 1. Si considera, quindi, che in questo gruppo di 5 esiste un campione non reattivo quando il coefficiente S/N è < valore di cutoff, mentre un pool S/N > cutoff può indicare la presenza di almeno un campione reattivo. In questo caso, è necessario ritestare i singoli campioni per identificare il campione (o i campioni) reattivo. Tutti i test vengono eseguiti in duplicato.
In conformità a quanto sopra, la specificità è stata valutata mediante la valutazione dell’HBsAg in 50 pool di 250 sieri negativi. Per calcolare la sensibilità, 40 sieri con la stessa distribuzione di concentrazione della popolazione generale da cui sono stati prelevati sono stati analizzati in un pool con 4 sieri negativi.
Sottotipi di HBsAg (ad e ay)
Il limite di rilevamento di Imx HBsAg per ad e ay è stato valutato utilizzando sieri di un pannello di sottotipi di HBsAg purificati (pannello di sensibilità dell’epatite HBsAg, Abbott Laboratories). Le concentrazioni di HBsAg/ad e HBsAg/ay variavano rispettivamente da 0,13 a 2,32 ng/mL e da 0,21 a 2,24 ng/mL. Il limite di rilevazione è stato determinato in un singolo e in un pool con 4 sieri HBsAg negativi.
Influenza del livello di anti-HBs
Per accertare se l’esistenza di anticorpi anti-HBs nei sieri studiati con il test in pool potesse neutralizzare l’HBsAg e interferire con la sensibilità della tecnica, abbiamo applicato il metodo del pooling di un siero con una concentrazione nota di HBsAg/ad e HBsAg/ay con quattro sieri con titoli noti di anti-HBs.
La determinazione quantitativa degli anti-HBs è stata effettuata con un metodo immunoenzimatico a microparticelle (mEIA) utilizzando un autoanalizzatore AxSYm (AxSYmTM AUSAB, Abbott Laboratories, Abbott Park, IL). I sieri con titoli elevati di anti-HBs sono stati ottenuti da controlli HBV post-vaccinati e da pazienti guariti dall’epatite B.
Pool-test nello screening dell’HBsAg
Al fine di valutare la validità del pool test, è stata condotta una simulazione delle operazioni sul campo utilizzando il metodo di cui sopra su 1.525 campioni di siero ottenuti da donne incinte in un nostro precedente studio per stimare la prevalenza dell’infezione da HCV, e i cui campioni sono stati conservati a -20 ºC dopo la raccolta. Tra questi abbiamo selezionato a caso 300 campioni HBsAg negativi e 14 campioni HBsAg positivi. Le determinazioni sono state effettuate senza alcuna conoscenza precedente della composizione dei pool.
Riduzione del numero di test
Quando un pool risulta positivo, è necessario ritestare individualmente ogni componente per identificare il campione o i campioni HBsAg-positivi. Pertanto, maggiore è il numero di pool positivi (cioè la prevalenza dell’HBsAg), minore è la riduzione del numero di test eseguiti.
Su questa base, la riduzione percentuale del numero di test quando è stato utilizzato lo screening dei sieri in pool per l’HBsAg è stata calcolata nelle condizioni più sfavorevoli e improbabili (bassa prevalenza), cioè quando non era presente più di un siero positivo in nessuno dei pool. Ad esempio, per una sieroprevalenza di HBsAg del 2%, se vengono analizzati 100 sieri in 20 pool, 2 di questi saranno positivi. Quindi, è necessario aggiungere 10 determinazioni (10 sieri ritestati singolarmente) alle 20 iniziali (20 pool), ottenendo così 30 determinazioni in totale. In questo esempio, il 70% del costo potrebbe essere risparmiato. Per effettuare un’analisi costi-benefici, il prezzo del test HBsAg è stato stimato in 3 dollari USA per ogni campione. Questo essendo basato sul prezzo medio effettivo del kit commerciale nel nostro ospedale.
Analisi statistica
I dati sono stati raccolti in un database e successivamente analizzati utilizzando il pacchetto statistico SPSS per Windows, Release 10.0. È stata utilizzata la correlazione lineare non parametrica di Spearman. I risultati sono espressi come media ± SD. Un livello di p < 0,05 è stato considerato statisticamente significativo.
Risultati
Nessuno dei 50 pool di sieri HBsAg-negativi è risultato positivo (pool S/N > 1), e sono stati ottenuti i seguenti valori di pool S/N 0,767 ± 0,076 (range 0,67-0,88). Con questo campione, la specificità di questa tecnica di pooling era quindi del 100%. D’altra parte, tutti i 40 sieri HBsAg-positivi, quando sono stati determinati in forma di pool, hanno dato valori S/N superiori a 1 (anche la sensibilità era del 100%). Il coefficiente di correlazione tra i rapporti S/N per questi 40 campioni studiati in singolo e in pool è stato di 0,792 (p < 0,05).
Il 26,6% dei pool con campioni con titoli elevati di HBsAg aveva un rapporto S/N ancora maggiore del singolo campione. Tuttavia, il coefficiente di correlazione dei campioni con titoli HBsAg bassi (S/N singolo < 25, n = 12) era eccellente (R = 0,9739, p < 0,05), come si può vedere (Fig. 1).

Il limite di rilevazione con il metodo singolo era 0.34 ng/mL per il sottotipo ad e 0,29 ng/mL per il sottotipo ay, mentre per il metodo pooling sono stati rilevati livelli inferiori di antigene: 0,20 ng/mL e 0,12 ng/mL, rispettivamente. I risultati dell’applicazione delle tecniche singole e in pool a sieri con diverse concentrazioni di HBsAg/ad e HBsAg/ay sono mostrati (Fig. 2).

Quando il titolo di anti-HBs nel pool è inferiore a 100 IU/L, la tecnica non perde sensibilità; anche quando il titolo di anti-HBs raggiunge 10.000 IU/L, la tecnica è ancora in grado di rilevare concentrazioni di HBsAg fino a 1,5 ng/mL. L’influenza delle diverse concentrazioni di anti-HBs sul limite di rilevazione dei sottotipi di HBsAg quando si usa il metodo del pooling sono presentate (media di 2 determinazioni) (Fig. 3).
Nell’indagine condotta in condizioni reali nei sieri di donne incinte, il metodo del pooling ha portato alla corretta classificazione di tutti i campioni analizzati. Di conseguenza, la sensibilità e la specificità erano del 100%.
C’è una diminuzione della percentuale di riduzione del numero di test ottenuti con il metodo del pooling all’aumentare della sieroprevalenza di HBsAg. Si può notare che anche con prevalenze di HBsAg del 10% nel campione studiato, si raggiunge un risparmio minimo di almeno il 30% (Fig. 4).

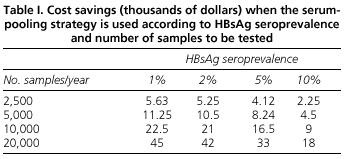
L’analisi dei benefici economici della strategia di pooling del siero mostra che il risparmio ottenuto dipende sia dalla prevalenza di HBsAg che dal numero di determinazioni da effettuare. Così, per i paesi con una bassa prevalenza come il nostro, il metodo del pooling riduce il costo dei test per l’HBsAg. Ad esempio, abbiamo stimato che per 2.500 determinazioni effettuate in un laboratorio durante un anno utilizzando il metodo del pooling, il risparmio sarà di 5.630 dollari USA, e nel caso di un ospedale molto frequentato che effettua 20.000 determinazioni all’anno, il risparmio raggiungerà i 45.000 dollari USA (Tabella I).
Discussione
Un approccio al metodo del pooling è quello di mantenere la diluizione e il volume finale della miscela di reazione in ogni test in pool per non perdere la sensibilità, per cui il diluente viene ridotto, e parzialmente sostituito dai sieri aggiuntivi. In questo modo non è necessario modificare il valore di cutoff rispetto al metodo standard nei campioni individualizzati. Tuttavia, il metodo utilizzato nel nostro studio era automatizzato e la diluizione del campione è stata eseguita da un autoanalizzatore. Per questo motivo, ogni campione mostra una diluizione di 1 su 5 quando viene mescolato con gli altri 4 sieri. Pertanto, nel nostro studio è stato necessario modificare il valore di cutoff e limitare il numero di sieri nel pool per non perdere la sensibilità.
Per quanto riguarda la specificità, è necessario notare che il valore medio per i pool era solo poco più di 3 deviazioni standard dal cutoff. Quindi, ci si potrebbe aspettare un falso positivo in circa l’1% delle occasioni. Pensiamo che questo sia accettabile, dato che la specificità è quasi del 100% (99,9%). Uno studio con un numero maggiore di campioni negativi da un gran numero di individui diversi sarà necessario per stabilire la vera specificità di questo test.
Anche se la correlazione tra i test su campioni singoli e in pool è buona, la linea di regressione intercetta l’asse X ad un rapporto S/N di 3 (il corrispondente valore Y è 1). Questo può significare che qualsiasi campione con un rapporto S/N tra 2 e 3 nel test a campione singolo avrebbe un valore inferiore a 1 e quindi non sarebbe rilevato nel test in pool.
Per una prevalenza dell’1% di sieri HBsAg-positivi, un modello matematico descritto da Liu et al. (19) ha ottenuto la massima riduzione (80,5%) del numero di test per un pool di 11 sieri. Tuttavia, secondo noi, potrebbe sorgere un problema di specificità dovuto all’effetto del pooling sul tasso di falsi positivi. Un aumento delle proteine aspecifiche, come risultato della mescolanza dei sieri, può dare origine a un aumento del colore di fondo. Con la dimensione del pool di 5 scelta per il nostro studio e la modifica del valore di cutoff da 2 a 1, non sono state osservate perdite di sensibilità (falsi negativi) o specificità (falsi positivi).
I risultati del presente studio dimostrano che la tecnica del pooling dei sieri per la rilevazione dell’HBsAg è altamente sensibile e specifica e consente anche un notevole risparmio economico. Questi risultati sono simili a quelli ottenuti da altri ricercatori che hanno applicato il metodo del pooling allo studio dell’infezione da HCV e HIV (5-19). Fino ad oggi, sono stati riportati solo due studi (20,21) riguardanti l’applicazione del metodo del pooling allo studio dell’infezione da HBV. In uno di questi (20), eseguito durante lo screening prenatale di routine per l’epatite B analizzando 10 pool di campioni, gli autori hanno riscontrato una bassa prevalenza di portatori cronici (0,43%), e concludono che questo è un metodo economicamente vantaggioso e una strategia valida nelle aree a bassa sieroprevalenza, con una riduzione della sensibilità stimata al 4,2%. L’applicazione nel nostro studio del metodo del pooling alle donne incinte, tra le quali la prevalenza di portatori cronici di HBsAg è dello 0,93%, ha dimostrato una sensibilità e specificità del 100%.
La distribuzione dei due principali sottotipi di HBsAg (ad e ay) nel nostro ambiente è di circa il 50% per ciascuno, essendo ay più frequente nei tossicodipendenti che utilizzano la via parenterale (22). Abbiamo dimostrato che il metodo del pooling migliora la sensibilità, cioè diminuisce il limite di rilevamento di un test immunologico utilizzato per la determinazione dei due principali sottotipi di HBsAg. La nostra tecnica di pooling permette di rilevare quantità pari a 0,20 ng/mL di HBsAg/ad, e 0,12 ng/mL di HBsAg/ay, addirittura inferiori a quelle ottenute con il metodo standard. Il riscontro di una maggiore sensibilità con il pool test non è sorprendente, in quanto è stato riportato da altri autori (16). È importante valutare la sensibilità del kit EIA utilizzato per il pool test, perché non tutti i kit possono essere adatti allo screening dei pool, come è stato dimostrato nel caso degli anticorpi contro il virus dell’epatite C (23,24).
La presenza di anti-HB nei sieri del pool potrebbe modificare la sensibilità della tecnica, ma solo in modo significativo in titoli superiori a 10.000 UI/mL, osservati solo in campioni provenienti da studi di controllo post-vaccinazione; in questa situazione, la determinazione dell’HBsAg non è indicata. Infatti, Cunninghan et al. (20) hanno trovato che solo il 4,5% dei pool composti da sieri di donne incinte aveva un titolo anti-HBs superiore a 7.500 IU/L. Tenendo conto di questa limitazione della sensibilità del metodo di pooling, hanno trovato che questo era anche intorno al 100% in sensibilità e specificità. I nostri risultati potrebbero essere riproducibili in altre aree a bassa prevalenza, ma dovrebbero essere dimostrati in precedenza in aree ad alta endemicità per l’HBV. In queste aree, la maggior parte della popolazione è già immunizzata contro questo virus, ed è possibile che i titoli anti-HBs riscontrati nei sieri siano leggermente elevati.
Rabenau et al. (21) hanno studiato la sicurezza dei test sierologici in pool di plasma per l’HBsAg utilizzando un sistema EIA simile al nostro. Nel loro studio, la rilevazione dell’HBsAg è stata influenzata dalla presenza di bassi titoli anti-HBs dopo 5 ore di incubazione. Tuttavia, dopo la dissociazione dell’immunocomplesso, l’HBsAg era ancora rilevabile nel pool anche in presenza di un alto contenuto di anti-HBs. Nel nostro studio abbiamo dimostrato che solo una diminuzione significativa della sensibilità risulta per titoli anti-HBs superiori a 10.000 IU/L. Queste differenze possono essere dovute al fatto che nel nostro caso i campioni sono stati testati senza una precedente incubazione. Questo potrebbe impedire la neutralizzazione dell’antigene attraverso la formazione di immunocomplessi.
Crediamo quindi che, sia il titolo di anti-HBs nel siero che il trattamento pre-test dei campioni con EIA possano influenzare la sensibilità del metodo di pooling. Ogni laboratorio che desideri utilizzare questa tecnica dovrebbe tenere conto di questi due fattori prima di un utilizzo generalizzato.
L’OMS raccomanda l’utilizzo del metodo di pooling del siero in caso di infezione da HIV, quando la prevalenza della malattia è inferiore al 2%, e con un pooling massimo di 5 sieri (25). Seguendo queste indicazioni, la maggior parte degli studi applica e raccomanda l’uso di tecniche di pooling in aree a bassa sieroprevalenza. Nel nostro studio, dimostriamo che il pooling dei sieri può essere conveniente anche in popolazioni con un’alta prevalenza di portatori di HBsAg. Questo potrebbe permettere il suo utilizzo in paesi appartenenti ad aree di media e alta endemicità per l’infezione da HBV, che in generale coincide con i paesi sottosviluppati o in via di sviluppo, cioè quelli che hanno una maggiore necessità di ridurre i costi economici legati ai test di laboratorio. Tuttavia, sarà necessario realizzare studi simili in queste aree per confermare i nostri risultati. Tuttavia, è già stato dimostrato che in paesi come il Kenya, che ha un’alta frequenza di infezione da HIV (7,3%), l’applicazione del pooling per la sua rilevazione permetterebbe un risparmio economico del 62% senza una significativa perdita di sicurezza (14). In Spagna, paese appartenente ad un’area a bassa endemicità per l’infezione da HBV, e con una frequenza di portatori di HBsAg nella popolazione generale dell’1,2% (4), può essere utilizzato in tutti quei gruppi in cui lo screening per HBsAg è attualmente obbligatorio (come donatori di sangue, soggetti sottoposti a programmi di autotrasfusione, screening delle donne in gravidanza).
Lo studio costi-benefici dell’applicazione delle tecniche per l’individuazione dei portatori cronici di HBV permette di dimostrare che il risparmio economico è maggiore se effettuato in un gran numero di determinazioni in gruppi a bassa sieroprevalenza, e il suo utilizzo potrebbe essere economicamente vantaggioso anche in aree ad alta prevalenza di infezione, e anche in laboratori che effettuano un piccolo numero di determinazioni. Abbiamo dimostrato un risparmio economico in base sia alla diversa prevalenza di HBsAg che al numero di test da eseguire annualmente. Nella nostra area, l’applicazione del metodo di pooling potrebbe far risparmiare circa il 74% dei costi economici totali rispetto al metodo singolo.
Alcuni ricercatori hanno recentemente iniziato a praticare strategie per la rilevazione di acidi nucleici virali nei donatori di sangue utilizzando la reazione a catena della polimerasi (PCR) al fine di aumentare la sicurezza che comporta la trasfusione di derivati del sangue (26-29). A causa dell’impossibilità di effettuare screening individuali per problemi economici e di lavoro, è in uso il metodo di raggruppamento di campioni di sangue sierologicamente negativi. Questa procedura potrebbe aumentare la sicurezza del sangue attraverso uno screening sistematico delle donazioni di sangue ad un costo relativamente basso. Poiché una delle principali limitazioni nella pratica di questi metodi è economica, crediamo che, con il nostro studio, ci potrebbe essere una base teorica per l’uso dello screening per le infezioni da HBV, HCV e HIV in due fasi ad un costo economico relativamente basso. Nella prima fase un EIA commerciale potrebbe essere applicato a un pool di sieri di donatori; nella seconda fase, l’applicazione di tecniche PCR a un pool di campioni sieronegativi potrebbe aumentare la sicurezza dell’analisi. Fino a quando gli studi futuri non potranno dimostrare il valore di questa tecnica con i donatori di sangue, riteniamo che possa essere applicata solo ai test diagnostici ed epidemiologici.
Concludiamo che l’applicazione dell’EIA ai sieri in pool è un metodo sensibile e specifico nell’individuazione dei due principali sottotipi di HBsAg in una zona a bassa sieroprevalenza. La sensibilità diminuisce solo quando esistono titoli molto alti di anti-HBs nei sieri raggruppati. La tecnica del pooling è un metodo che può anche consentire un risparmio economico se impiegato nello studio di popolazioni con un’alta prevalenza di portatori di HBsAg. Crediamo che siano necessari ulteriori studi per confermare questi risultati.
Riconoscimenti
Vogliamo ringraziare David H. Wallace (membro della European Association of Science Editors e del Council of Biological Editors) per la traduzione in lingua inglese del manoscritto.
1. Maynard JE. Epatite B: importanza globale e necessità di controllo. Vaccine 1990; 8 (Supl.): 18s-20s.
2. Margolis HS, Alter MJ, Hadler SC. Epatite B: epidemiologia in evoluzione e implicazioni per il controllo. Sem Liver Dis 1991; 11: 84-92.
3. Alter MJ, Mast EE. L’epidemiologia dell’epatite virale negli Stati Uniti. Gastroenterol Clin North Am 1994; 23: 437-55.
4. Suárez A, Riestra S, Navascués CA, et al. Donatori di sangue HBsAg positivi nelle Asturie (Spagna): prevalenza attuale e il suo significato. (abstract inglese). Med Clin (Barcelona) 1994; 102: 329-32.
5. Emmanuel JC, Basset MT, Smith HJ, Jacobs JA. Pooling di sieri per il test del virus dell’immunodeficienza umana (HIV): un metodo economico da usare nei paesi in via di sviluppo. J Clin Pathol 1988; 41: 582-5.
6. Kline RL, Brothers TA, Brookmeyer R, et al. Valutazione della sieroprevalenza del virus dell’immunodeficienza umana in indagini sulla popolazione utilizzando sieri in pool. J Clin Microbiol 1989; 27: 1449-52.
7. Cahoon-Young B, Chandler A, Livermore T, et al. Sensibilità e specificità dei sieri raggruppati rispetto a quelli individuali in uno studio di prevalenza degli anticorpi del virus dell’immunodeficienza umana. J Clin Microbiol 1989; 27: 1893-5.
8. Frosner GG, Dobler G, von Sonnenburg FJ. Riduzione dei costi dei test non collegati per l’anti-HIV attraverso l’indagine dei sieri in pool. AIDS 1990; 4: 73-5.
9. Behets F, Bertozzi S, Kasali M, et al. Uso di successo dei sieri in pool per determinare la sieroprevalenza di HIV-1 in Zaire con lo sviluppo di modelli di efficienza dei costi. AIDS 1990; 4: 737-41.
10. Monzon OT, Paladin FJ, Dimaandal E, et al. Rilevanza del contenuto anticorpale e del formato del test nel test HIV dei sieri in pool. AIDS 1992; 6: 43-8.
11. Tamashiro H, Maskill W, Emmanuel J, et al. Ridurre il costo del test degli anticorpi HIV. Lancet 1993; 342: 87-90.
12. Perriens JH, Magazani K, Kapila N, et al. Uso di un test rapido e un ELISA per lo screening degli anticorpi HIV di campioni di siero in comune a Lubumbashi, Zaire. J Virol Methods 1993; 41: 213-21.
13. McMahon EJ, Fang C, Layug L, Sandler SG. Mettere in comune i campioni dei donatori di sangue per ridurre il costo del test degli anticorpi HIV-1. Vox Sang 1995; 68: 215-9.
14. Verstraeten T, Farah B, Duchateau L, Matu R. Pooling sera to reduce the cost of HIV surveillance: a feasibility study in a rural Kenyan district. Trop Med Int Health 1998; 3: 747-50.
15. Kamel MA, Ghaffar YA, Wasef MA, et al. Alta prevalenza di HCV nei donatori di sangue egiziani. Lancet 1992; 340: 427.
16. Neil AGS, Conradie JD. Screening anti-HCV a basso costo dei donatori di sangue. Lancet 1992; 340: 1096.
17. Fernández E, Riestra S, García S, Rodríguez S. Pool test per la rilevazione dell’infezione da virus dell’epatite C. J Hepatol 1995; 23: 236.
18. García Z, Taylor L, Ruano A, et al. Valutazione di un metodo di pooling per lo screening di routine anti-HCV dei donatori di sangue per ridurre l’onere dei costi delle banche del sangue nei paesi in via di sviluppo. J Med Virol 1996; 49: 218-22.
19. Liu P, Shi ZX, Zhang YC, et al. Uno studio prospettico di una strategia di pooling del siero nello screening dei donatori di sangue per gli anticorpi al virus dell’epatite C. Trasfusione 1997; 37: 732-6.
20. Cunningham R, Northwood JL, Kelly CD, et al. Screening prenatale di routine per l’epatite B utilizzando sieri in pool: convalida e revisione di 10 anni di esperienza. J Clin Pathol 1998; 51: 392-5.
21. 21. Rabenau H, Schutz R, Berger A, et al. Quanto è accurato il test sierologico di pool di plasma per l’antigene di superficie del virus dell’epatite B, virus dell’immunodeficienza umana 1 e 2 e virus dell’epatite C? (Engl abstract). Infus Transfus 1996; 23: 124-30.
22. Echevarría JE, León P, López JA, et al. HBsAg subtype distribution among different populations of HBsAg carriers in Spain. Eur J Epidemiol 1995; 11: 39-45.
23. Neill AGS, Conradie JD. Test in pool per il virus dell’epatite C. Lancet 1994; 343: 738.
24. Liu P, Shi ZX, Zhang YC, Zhang XY. Studio comparativo su 4 kit EIA per lo screening degli anticorpi del virus dell’epatite C nei sieri in pool. Biomed Environ Sci 1998; 11: 75-80.
25. Raccomandazioni per il test dell’anticorpo dell’HIV nel pool di sieri. WHO Weekly Epidemiol Rec 1991; 44: 316-27.
26. Lefrere JJ, Coste J, Defer C, et al. Screening delle donazioni di sangue per i genomi virali: studio multicentrico di simulazione in tempo reale utilizzando campioni in pool sul modello di rilevamento del virus dell’epatite C RNA. Trasfusione 1998; 38: 915-23.
27. Yerly S, Pedrocchi M, Perrin L. L’uso della reazione a catena della polimerasi in pool di plasma per il rilevamento concomitante del virus dell’epatite C e dell’HIV tipo 1 RNA. Trasfusione 1998; 38: 908-14.
28. Schottstedt V, Tuma W, Bunger G, Lefevre H. PCR per HBV, HCV e HIV-1 esperienze e primi risultati di un programma di screening di routine in un grande servizio trasfusionale. Biologicals 1998; 26: 101-4.
29. Morandi PA, Schockmel GA, Yerly S, et al. Detection of human immunodeficiency virus type 1 (HIV-1) RNA in pool di sieri negativi per gli anticorpi contro HIV-1 e HIV-2. J Clin Microbiol 1998; 36: 1534-8.
Lascia un commento