Nella reazione con l’ammoniaca, perché l’acqua è un acido?
Questa è una grande reazione di chimica generale con importanti implicazioni di chimica organica. Un’altra domanda simile è: perché l’acqua è una base quando reagisce con un “acido”? La risposta ad entrambe le domande è: è tutto relativo! Qui a StudyOrgo, riceviamo spesso domande come questa su argomenti di chimica organica che di solito sono trattati velocemente, descritti male o che ci si aspetta di conoscere dai corsi precedenti. Questi concetti sono davvero importanti per capire gli argomenti più complessi che verranno. Con un’iscrizione a StudyOrgo, otterrai ancora più consigli e suggerimenti sugli argomenti di chimica organica e meccanismi dettagliati con spiegazioni. Il blog di oggi è un’anteprima degli argomenti dettagliati e dei materiali disponibili. Controlla un abbonamento a StudyOrgo.com e iscriviti oggi stesso!
Ricorda che in termini di acidi e basi, ci sono due definizioni: quella di Bronsted e quella di Lewis. Gli acidi di Bronsted sono definiti come donatori di protoni, mentre gli acidi di Lewis sono definiti come accettatori di elettroni. Entrambi sono acidi, ma ciò che pensiamo in modo diverso è se sono coinvolti protoni o elettroni. In una soluzione acquosa, in chimica generale o in biochimica, pensiamo principalmente alla definizione di Bronsted perché la dissociazione dei protoni dagli acidi cambia la concentrazione di H+ nella soluzione, che interpretiamo come un cambiamento del pH e l'”acidità” della soluzione. Misuriamo la dissociazione dei protoni dagli acidi, o l’accettazione dei protoni da parte delle basi, con un valore numerico che è il pKa. Maggiore è il pKa, più debole è l’acido e più forte la base. Più basso è il pKa, più forte è l’acido e più debole la base. Un facile trucco per pensare al pKa è mettere la versione protonata della molecola sulla sinistra e pensare ad essa come ad un donatore di protoni. Il pKa ti dice quanto sarà facile questa donazione, più basso è il numero più facile è la donazione di protoni.
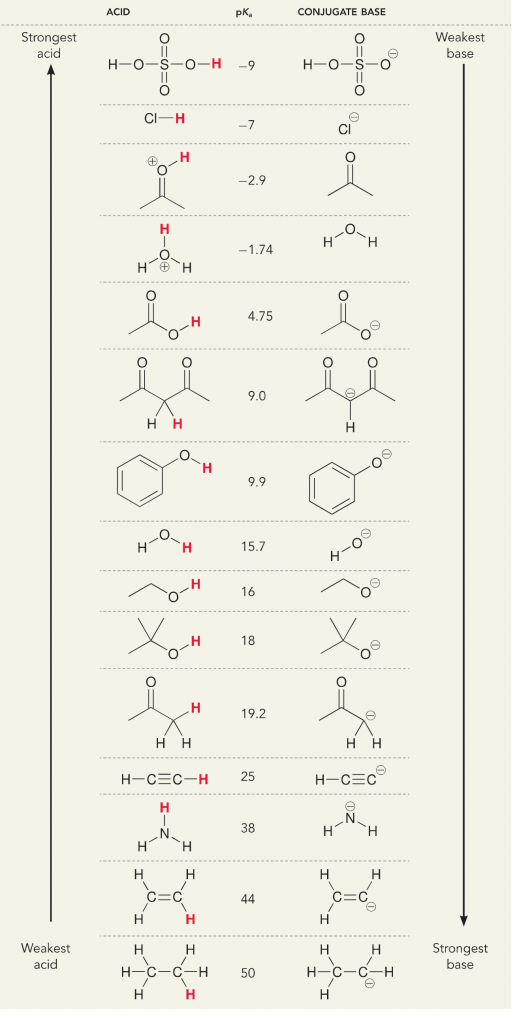
Guardiamo la reazione ammoniaca e acqua; il pKa per l’acqua è definito come 14. Il pKa per l’ammoniaca è ~37.
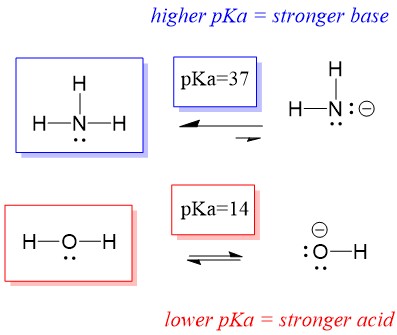
Quindi, poiché il pKa dell’acqua è inferiore a quello dell’ammoniaca, è un acido più forte dell’ammoniaca e donerà protoni alla base dell’ammoniaca. Questa reazione porta l’acqua a diventare la base coniugata OH- e l’ammoniaca a diventare l’acido coniugato NH4+. È interessante notare che questo è il motivo per cui l’ammoniaca è un agente caustico, produce idrossido che reagisce con le macchie e i microrganismi per pulire e igienizzare efficacemente gli oggetti domestici.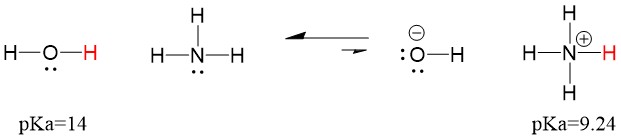
Questo è importante come concetto di chimica organica perché la forza degli acidi e delle basi in termini di elettroni, o la definizione di Lewis, è esattamente come pensiamo ai meccanismi di rottura e formazione dei legami; il flusso di elettroni. La forza degli acidi di Lewis e dell’acido coniugato può aiutare a identificare in quale direzione procederà una reazione. Possiamo vedere che la reazione di acqua e ammoniaca è sfavorevole, ma abbastanza della reazione si verifica in realtà per ridurre significativamente il pH dell’acqua (pH~11 con l’ammoniaca).
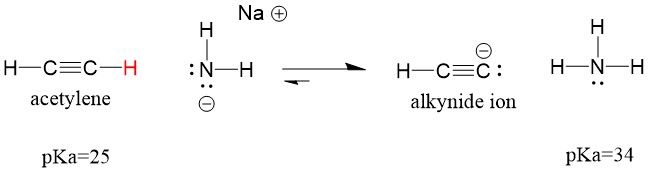
Guardiamo un acetilene che reagisce con una base per generare uno ione alchinide, un nucleofilo utile per la formazione del legame C-C. Se proviamo a far reagire l’idrossido di sodio con l’alchene, lo ione alchinide NON si formerà. Questo perché il prodotto acido coniugato della reazione è l’acqua, che ha un pKa di 15, è più forte dell’acetilene acido originale (pKa = 25). Le reazioni favoriscono SEMPRE la formazione dell’acido più debole, o in questo caso, il lato reagente.
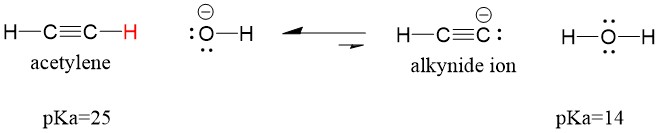
Se cambiamo la nostra base in sodio ammide, che è una base molto più forte, si formerà lo ione alchinide. Questo perché il prodotto acido coniugato della reazione è l’ammoniaca, che ha un pKa di 38, ed è un acido coniugato più DEBOLE dell’acetilene acido originale (pKa = 25). In questo caso, la reazione favorisce il lato prodotto!

Lascia un commento