Keywords
CADASIL – stroke – MRI
Introduzione
Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leucoencephalopathy (CADASIL) è una malattia ereditaria delle piccole arterie causata da diverse mutazioni patogenetiche del gene NOTCH-3. È caratterizzata dall’associazione di emicrania con aura, sintomi psichiatrici, eventi ischemici ricorrenti in giovane età e deterioramento cognitivo. Questo e i suoi tipici reperti radiologici sono ciò che normalmente ci aiutano a sospettare la malattia. Di solito è considerata una malattia dei giovani e degli adulti di mezza età, ma i casi negli anziani possono essere sottodiagnosticati. Riportiamo il caso di un uomo a cui è stata diagnosticata la CADASIL alla fine dei settant’anni grazie alla precedente diagnosi di sua figlia.
Case Reports
Caso 1
La figlia del nostro paziente aveva 50 anni quando è stata inviata al nostro ospedale dall’ambulatorio di neurologia per ulteriori studi, a causa dei risultati radiologici nella sua risonanza magnetica del cervello, che consistevano in cambiamenti della materia bianca in entrambe le capsule esterne, aree periventricolari bilaterali e lobo temporale sinistro.
Si recava presso la suddetta clinica perché da 30 anni soffriva di emicrania con aura visiva, con alcuni episodi che suggerivano un’aura visiva senza mal di testa. Non aveva altri sintomi. Era allergica alla fosfomicina e aveva subito una tonsillectomia da bambina. Non aveva altri precedenti medici. La sua storia familiare era notevole: sua madre aveva emicrania e demenza lieve e suo padre aveva avuto un ictus all’età di 75 anni; suo nonno paterno, suo zio e sua zia avevano avuto un ictus, e allo zio era stata diagnosticata la malattia di Alzheimer, un cugino paterno aveva ricevuto altrove la diagnosi di “vasculite ANA+” e un altro cugino paterno aveva ricevuto la diagnosi di sclerosi multipla. Aveva due figli sani. L’esame fisico, compresa una meticolosa esplorazione neurologica, era completamente normale. La risonanza magnetica ripetuta dell’encefalo ha mostrato lesioni multiple iperintense nella materia bianca della protuberanza posteriore, nelle aree periventricolari e sottocorticali, compresi i lobi temporali anteriori, specialmente quello sinistro, entrambi i centrum semiovale, le capsule interne ed esterne, senza segni di microbleeds recenti o passati (figura 1). Tutti gli altri esami, tra cui emogramma, glucemia, funzionalità epatica e renale, velocità di eritrosedimentazione, ormoni tiroidei sierici, screening dell’ipercoagulabilità, screening delle vasculiti, ECG, radiografia del torace, sierologie per sifilide e HIV, ed ecografia dei tronchi sovraaortici con Doppler, erano normali, tranne che per una colesterolemia di 220 mg/dl con colesterolo LDL di 152 mg/dl. Anche la biopsia della pelle era normale. Una mutazione Arg169Cys (sostituzione da citosina a timina nel codone 505) è stata trovata nel quarto esone del gene NOTCH 3, che è noto per essere patogenetico, quindi è stata diagnosticata la CADASIL. Con questa diagnosi, entrambi i genitori sono stati valutati nella nostra clinica.
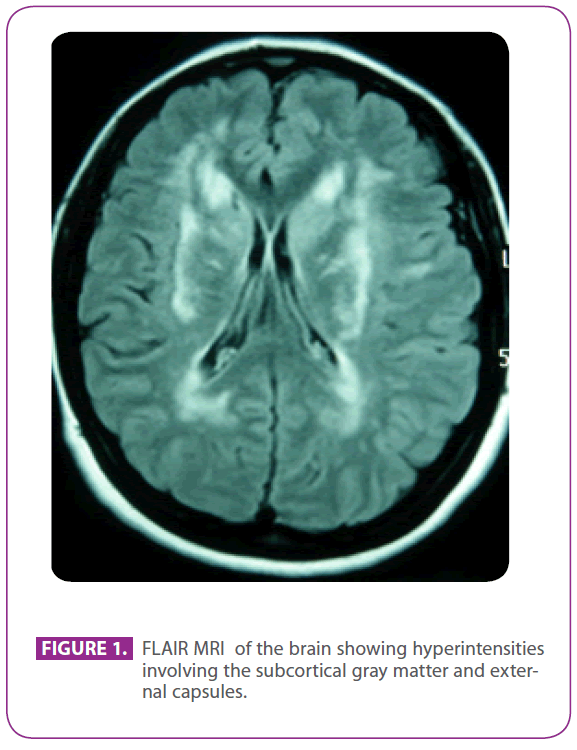
Figura 1: RM FLAIR del cervello che mostra iperintensità che coinvolgono la materia grigia sottocorticale e le capsule esterne.
Caso 2
La madre aveva 78 anni. Aveva una lunga storia di emicrania senza aura e, negli ultimi due anni, aveva sviluppato una demenza lieve con parkinsonismo simmetrico, fluttuazioni e disturbo del comportamento nel sonno REM, suggestivo di demenza a corpi di Lewy. La risonanza magnetica cerebrale ha escluso una malattia rilevante della materia bianca.
Il padre era un uomo di 79 anni con diversi fattori di rischio vascolare: diabete mellito di tipo 2, dislipidemia, e un fumo per 50 anni, con un indice accumulato di 15 pacchetti-anno, anche se aveva smesso 3 anni fa. Aveva una cardiopatia ischemica con un infarto miocardico postero-inferiore nel 1991. Negli ultimi 8 anni aveva avuto tre incidenti ischemici transitori e un ictus lacunare corrispondenti a diversi territori arteriosi, con progressiva compromissione della deambulazione, e negli ultimi 6 mesi era diventato un po’ ritirato e apatico. Non aveva una storia di emicrania. Prendeva metformina, clopidogrel, atenololo e atorvastatina. All’esame fisico era cosciente e orientato ma un po’ disattento, il linguaggio e la memoria remota e recente erano normali, mostrava aprassia ideomotoria, interpretazione alterata di somiglianze e detti, senza riflessi di rilascio frontale. Mostrava anche iperreflessia globale con riflessi plantari flessori bilaterali, e un’andatura con passi brevi e movimenti ridotti delle braccia. Una TAC eseguita due anni prima, dopo uno dei suoi attacchi ischemici transitori, ha mostrato un’estesa malattia della materia bianca, particolarmente prominente nella capsula esterna e nei lobi temporali (figura 2).
In sintesi, il paziente aveva ictus ischemici ricorrenti, lieve deterioramento cognitivo sottocorticale e leucoencefalopatia, altamente sospetta di CADASIL considerando la diagnosi della figlia. È stato eseguito un test genetico, che ha mostrato la stessa mutazione NOTCH 3 della figlia e ha confermato la diagnosi.
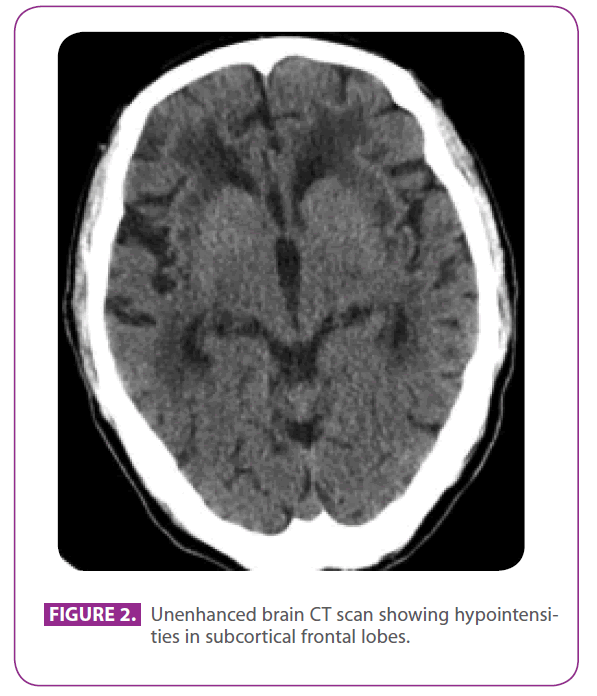
Figura 2: TAC cerebrale non potenziata che mostra ipointensità nei lobi frontali subcorticali.
Discussione
CADASIL è la più comune malattia ereditaria dei piccoli vasi. Tuttavia, può essere anche sporadica, poiché sono state descritte mutazioni de novo. È causata da diverse mutazioni patogene nel gene NOTCH-3, che si trova nel cromosoma 19, locus 19p13.2-p13.1, e consiste di 33 esoni che codificano una proteina di 2321 aminoacidi (1). Questa proteina è un recettore di superficie cellulare transmembrana a singolo passaggio espresso nelle cellule muscolari lisce arteriose sistemiche, con un dominio regolatore extracellulare e un dominio trasduttore intracellulare. Ci sono più di 190 mutazioni riportate fino ad oggi che possono portare a CADASIL, e tutte si verificano negli esoni da 2 a 24 del gene NOTCH 3, che codificano le 34 ripetizioni epidermiche simili al fattore di crescita della porzione extracellulare di NOTCH 3. Pertanto, lo screening di questi 23 esoni ha una sensibilità del 100% e quasi la stessa specificità (2). Di queste mutazioni, più di 180 sono mutazioni missenso, almeno 6 delezioni, una inserzione, un frameshift e 2 duplicazioni. La maggior parte delle mutazioni patogenetiche NOTCH3 si verifica negli esoni 3 e 4 (3).
Tutte le mutazioni risultano in un’aggiunta o perdita di un residuo di cisteina in una ripetizione EGF-like, e quindi un numero dispari di residui di cisteina che produce la formazione di ponti disolfuro anomali. Il NOTCH3 mutante causa la degenerazione delle cellule lisce vascolari nelle piccole arterie e arteriole e l’accumulo della proteina anomala nella parete di questi vasi, con conseguente stenosi del lume (1). Nel cervello colpisce le arterie cerebrali penetranti e leptomeningee, provocando l’incapacità di questi vasi di autoregolarsi e l’ipoperfusione dei territori da essi irrigati, e quindi infarti nella materia bianca.
Il primo sintomo della CADASIL, quando si presenta, è di solito l’emicrania con aura, con un’età media di esordio di 30 anni. Compare nel 20-40% dei pazienti (4). La maggior parte degli attacchi sono tipici con aura visiva o sensoriale, ma la metà dei pazienti ha anche attacchi atipici con aura basilare, emiplegica o prolungata.
Eventi ischemici sottocorticali, attacchi transitori o ictus, compaiono nel 60-85% dei pazienti, il primo all’età media di 50 anni, anche se può verificarsi già nella seconda decade. Il più delle volte non ci sono fattori di rischio vascolari convenzionali o non sono molto importanti. In due terzi dei pazienti gli eventi ischemici si presentano clinicamente e radiologicamente come sindromi lacunari. La maggior parte dei pazienti ha diversi ictus, di solito da 2 a 5, che portano in diversi anni a difficoltà di deambulazione, incontinenza urinaria e fecale, demenza e paralisi pseudobulbare (1). Il deterioramento cognitivo è la seconda manifestazione clinica più frequente. Il segno più precoce è di solito il deterioramento delle capacità esecutive e della velocità di elaborazione, che è presente nella maggior parte dei pazienti di età superiore ai 35 anni, ma può comparire già nella prima decade di vita (5). Questo deterioramento cognitivo è progressivo e normalmente peggiora con gli ictus ricorrenti, con l’aggiunta della compromissione delle attività strumentali, della memoria, del linguaggio, del ragionamento e delle abilità visuospaziali. Più del 70% dei pazienti sono dementi entro la sesta decade di vita. Afasia grave, aprassia o agnosia sono rare nella CADASIL.
Disturbi psichiatrici, soprattutto disturbi dell’umore, compaiono nel 20% dei pazienti, in generale come episodi depressivi gravi. L’apatia è presente nel 40% dei pazienti e non è correlata alla depressione Altre manifestazioni cliniche meno comuni sono l’encefalopatia reversibile acuta (6) (nel 10% dei pazienti), la maggior parte delle quali si verificano dopo un’emicrania con aura, convulsioni (nel 5-10% dei pazienti), sordità, parkinsonismo, emorragie cerebrali (soprattutto in pazienti con pressione alta), e infarto del miocardio.
Nonostante la sua completa penetranza, la CADASIL ha un’importante variabilità di espressione clinica inter e intrafamiliare. La stessa mutazione NOTCH-3 ha un ampio spettro clinico, senza chiare differenze tra pazienti omozigoti ed eterozigoti. Infatti, non c’è correlazione tra genotipo e fenotipo clinico (4). La ragione di queste differenze non è nota, ma sono stati descritti alcuni possibili modificatori del fenotipo della CADASIL, come il fumo attuale per il rischio di ictus e l’età del primo ictus, la pressione alta per il rischio di ictus, o i livelli di omocisteina per l’età di insorgenza dell’emicrania (3,4). Questi e altri fattori potrebbero influenzare l’espressione clinica della malattia modificando l’espressione genica o influenzando altre vie fisiopatologiche che possono portare alle stesse manifestazioni cliniche.
I cambiamenti radiologici appaiono in tutti gli individui con una mutazione CADASIL prima dei 35 anni e aumentano con il tempo. Le caratteristiche più precoci e frequenti sono aree puntiformi iperintense e non esaltanti nella materia bianca cerebrale e nelle strutture sottocorticali nelle immagini di risonanza magnetica pesate in T2 e con recupero di inversione attenuato dal fluido. Il coinvolgimento delle capsule esterne e della parte anteriore dei lobi temporali è tipico di questa malattia e un indizio per la diagnosi, in quanto aiutano nella diagnosi differenziale con altre condizioni come la malattia dei piccoli vasi (1).
CADASIL è comunemente considerata una malattia degli adulti giovani e di mezza età, ma il numero di pazienti anziani potrebbe essere sottodiagnosticato (7,8). Il nostro secondo caso può servire da esempio: un paziente di 79 anni con fattori di rischio vascolare e ictus ricorrenti, con malattia della sostanza bianca che è stata considerata secondaria alla malattia dei piccoli vasi da diversi neurologi. La diagnosi è stata raggiunta solo dopo la conoscenza della sua mutazione figlia. Nei casi senza una chiara storia familiare, una mente aperta e attenta ai risultati radiologici suggestivi come il coinvolgimento della capsula esterna o lobi temporali anteriori può essere l’unico indizio per una diagnosi corretta.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: una serie di casi di 11 pazienti. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. Spettro clinico di CADASIL e l’effetto dei fattori di rischio cardiovascolare sul fenotipo: studio in 200 individui reclutati consecutivamente. Colpo 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. L’influenza dei fattori di rischio genetici e cardiovascolari sul fenotipo CADASIL. Cervello. 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepezil in pazienti con deterioramento cognitivo subcorticale vascolare: uno studio randomizzato in doppio cieco in CADASIL. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. “CADASIL coma”: una sottodiagnosticata encefalopatia acuta. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. Omozigosi per una mutazione NOTCH3 in un paziente di 65 anni CADASIL con sintomi lievi: un rapporto di famiglia. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. L’espressività notevolmente variabile di CADASIL: rapporto di un uomo minimamente sintomatico in età avanzata. J Neurol. 2009;256:1026-7
Lascia un commento