Risultati
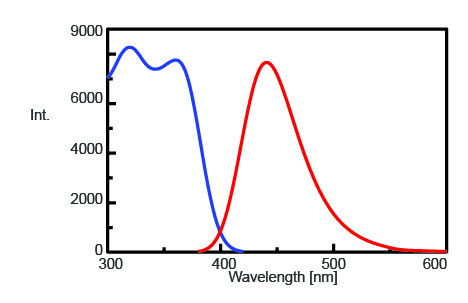
Per trovare la lunghezza d’onda massima di emissione per monitorare l’intensità della fluorescenza di AMC dopo la scissione della tripsina, sono stati misurati gli spettri di eccitazione ed emissione, mostrati nella figura 1. La lunghezza d’onda massima di emissione è risultata essere 440 nm.
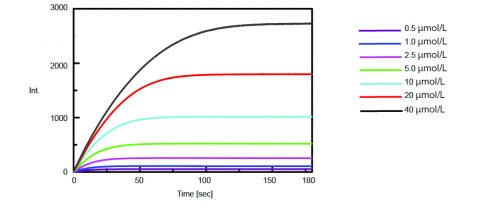
Per standardizzare l’intensità di fluorescenza misurata della soluzione enzimatica alla concentrazione di AMC isolata, è stata eseguita una titolazione e misurata la fluorescenza. Aliquote da 0,5 mL di una soluzione di AMC da 50 µmol/L sono state aggiunte a una soluzione enzimatica da 2,5 mL e le concentrazioni iniziali e finali di AMC isolata sono riassunte nella tabella 1.
Tabella 1. Concentrazioni di AMC isolate prima e dopo la standardizzazione dell’intensità di fluorescenza.
| Concentrazione iniziale | 3 | 6 | 15 | 30 | 60 | 120 | 240 |
| Concentrazione finale | 0.5 | 1 | 2.5 | 5 | 10 | 20 | 40 |
La cinetica dell’attività della tripsina è stata poi ottenuta misurando l’intensità di fluorescenza delle AMC isolate dopo la scissione della tripsina dal substrato. La figura 2 mostra la misurazione dell’andamento temporale dopo che 0,5 mL di varie concentrazioni della soluzione di substrato Boc-Gln-Ala-Arg-MCA sono stati aggiunti a 2,5 mL della soluzione enzimatica.
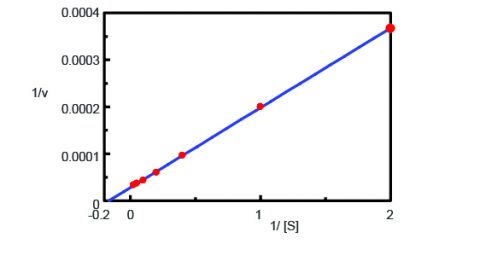
Utilizzando il programma di analisi cinetica, un grafico Lineweaver-Burk (Figura 3) è stato tracciato dalle misure del corso di tempo della fluorescenza nella Figura 2. Il grafico Lineweaver-Burk fornisce i parametri cinetici dell’enzima come la velocità massima della reazione, Vmax, e la costante di Michaelis-Menten, Km. Vmax descrive la velocità della reazione quando l’enzima è saturo di substrato mentre Km indica la quantità di substrato per raggiungere la massima velocità di reazione. Vmax era 35.270 nmol/L-min-1 e Km era 5,99. L’equazione della linea era 1/v = 0,000270 – 1/ + 0,0000284.
.
Lascia un commento