- Introduzione
- Sperimentale
- Materiali
- Sintesi dei composti di intercalazione
- Caratterizzazione
- Risultati e discussione
- Caratterizzazione XRD
- Spettri FTIR
- Modello strutturale dei composti di intercalazione Kaol/alchilamina
- Analisi termica
- Cinetiche di reazione di decomposizione
- Conclusioni
- Contributi degli autori
- Conflitto di interessi
- Riconoscimenti
Introduzione
La progettazione e la fabbricazione di nanocompositi di argilla/polimeri hanno attirato un grande interesse sia dalla comunità scientifica che ingegneristica (Cheng et al., 2017). Un’ampia varietà di nanocompositi argilla/polimero sono stati sviluppati e vengono utilizzati in applicazioni diffuse (Gogoi e Raidongia, 2017). Le argille pre-intercalanti seguite dall’incorporazione di polimeri nello strato di minerali argillosi è un approccio ampiamente adottato per la preparazione di nanocompositi argilla/polimero (Li et al., 2009; Zare et al., 2017). Mentre vengono intercalate all’interno di strati di argilla inorganica, le catene polimeriche organiche riducono naturalmente la loro mobilità strutturale e alcune di esse assumono una conformazione altamente organizzata all’interno della struttura stratificata.
In natura, la caolinite (Kaol) è un tipo di minerale argilloso con una struttura stratificata di silicato di alluminio dioctaedrico 1:1 (Brindley e Robinson, 1945). Gli strati di Kaol sono tenuti insieme da legami idrogeno, interazioni dipolo-dipolo e forze di van der Waals (Brindley et al., 1967). Tuttavia, solo un numero limitato di specie organiche altamente polari tra cui l’urea (Makó et al., 2009), il dimetilsolfossido (Costanzo e Giesse, 1986), la formamide (Frost et al., 2000a), l’idrazina (Cruz e Franco, 2000) e l’acetato di potassio (Frost et al., 2000b) sono stati intercalati con successo nella galleria di Kaol. L’intercalazione di piccole molecole negli strati di Kaol provoca un aumento della spaziatura basale, e può essere utilizzata come fase preliminare di espansione per il successivo inserimento di specie di grandi dimensioni e non reattive attraverso lo spostamento delle piccole molecole pre-intercalate (Cheng et al., 2015). Ad esempio, sulla base dei rapporti precedenti, un composto di intercalazione Kaol/metanolo può essere un efficace intermedio per ulteriori reazioni di intercalazione con glicole etilenico (Hirsemann et al., 2011), esilammina (Matusik et al., 2012), n-alchilammine (Gardolinski e Lagaly, 2005), e sali di ammonio quaternari (Cheng et al., 2016). Inoltre, la maggior parte delle molecole ospiti sono difficili da inserire nello spazio interstrato, uno dei motivi è il forte legame idrogeno, un altro è che non ci sono ioni scambiabili nella struttura Kaol.
Anche se i nanocompositi argilla/polimero sono stati ben sviluppati negli ultimi anni, sintetizzare nuovi nanocompositi argilla/organici per potenziali applicazioni presenta ancora una grande sfida (Kotal e Bhowmick, 2015). Al fine di risolvere questo problema, è davvero una questione urgente per capire il processo su scala nanometrica di intercalazione della caolinite e fare un’indagine approfondita al meccanismo di decomposizione con la tecnologia moderna e strumenti analitici. L’analisi termica e il calcolo cinetico dei composti di intercalazione argilla/polimero possono aiutare a caratterizzare i processi di decomposizione e fornire basi scientifiche per il controllo delle reazioni di intercalazione (Zhang et al., 2015). I parametri cinetici del processo di cinetica della reazione di decomposizione, come l’energia di attivazione, pre-esponenziale, ordini di reazione e costante di tasso sono stati valutati con i dati dai termogrammi di argilla/polimero. In questo studio, l’intercalazione di Kaol con varie alchilamine è stata studiata. Inoltre, il processo di intercalazione e il meccanismo di decomposizione sono stati studiati sistematicamente.
Sperimentale
Materiali
La caolina usata in questo studio è stata sfruttata da Zhangjiakou, Cina. La composizione minerale principale è una caolinite ben ordinata (95% in massa). È stato macinato per passare un setaccio a 325 maglie (particelle che misurano < 44 μm) prima dell’intercalazione. L’alchilammina esilammina (HA, 99%), dodecilammina (DA, chimicamente pura), e ottadecilammina (OA, chimicamente pura) sono stati acquistati da Nanjing Shuguang Chemical Company, Cina. Dimetil solfossido (DMSO, Reagente analitico), metanolo (MeOH, Reagente analitico), e toluene (99%) sono stati ricevuti da Xilong Chemical Company, Cina, e utilizzati come ricevuto senza ulteriore purificazione. La formula chimica e la formula strutturale di HA, DA e OA sono mostrate nella tabella 1.

Tabella 1. Formula chimica e strutturale di HA, DA e OA.
Sintesi dei composti di intercalazione
Prima, il composto di intercalazione Kaol/DMSO è stato preparato disperdendo 20,0 g di Kaol in una miscela di 36,0 g di DMSO e 4,0 g di acqua. La miscela è stata agitata in un bagno d’acqua per 2 ore a 95 ° C, e poi la sospensione è stata separata per centrifugazione con etanolo. In secondo luogo, il composto di intercalazione Kaol/DMSO è stato usato come precursore per un’ulteriore reazione con MeOH. MeOH è stato aggiunto al Kaol pre-intercalato e la miscela di reazione è stata agitata per 10 giorni, con MeOH sostituito ogni giorno con una stessa quantità di MeOH fresco. Il precipitato nella miscela è stato separato per centrifugazione e asciugato in un forno a 60°C per 12 ore per ottenere composti di intercalazione Kaol/MeOH. Infine, 2 g di composto di intercalazione Kaol/MeOH sono stati mescolati con 30,0 mL di soluzioni di metanolo HA, DA, o OA (1 mol/L) agitando a temperatura ambiente, rispettivamente. Le dispersioni sono state centrifugate dopo la reazione per 24 ore. I sedimenti sono stati lavati tre volte con toluene per rimuovere l’eccesso di HA, DA, o OA. I campioni sono stati essiccati a temperatura ambiente per 12 ore e macinati in polvere con un mortaio di agata (Komori et al., 1999). I composti risultanti sono etichettati come Kaolpi/HA (pi come pre-intercalato), Kaolpi/DA, e Kaolpi/OA.
Caratterizzazione
I modelli XRD sono stati registrati su un diffrattometro a raggi X Rigaku D/max 2500PC con radiazione Cu Kα (λ = 1,54178 Å) operante a 40 kV e 150 mA. I campioni orientati in modo casuale sono stati scansionati nell’intervallo di 2θ tra 1 e 20° ad una velocità di 2° min-1. Uno spettrofotometro Thermo Fisher Nicolet 6700 è stato utilizzato per registrare gli spettri FTIR nell’intervallo di 4.000 ~ 400 cm-1. Le analisi TG-DSC sono state eseguite con un analizzatore termico simultaneo Mettler-Toledo TG-DSC I/1600 HT in atmosfera di azoto. Venti milligrammi di campione sono stati posti in un crogiolo di allumina e riscaldati da 30 a 1.100°C con una serie di velocità di riscaldamento a 4, 6, 8, 10°C min-1.
Risultati e discussione
Caratterizzazione XRD
I modelli XRD del Kaol puro e dei suoi composti di intercalazione sono mostrati nella Figura 1. Il modello del Kaol incontaminato mostra una struttura a strati ben ordinata con una spaziatura basale di 0,71 nm. Questo valore corrisponde bene al modello standard di riferimento ICDD 14-0164 . Dopo essere stato trattato con DMSO, un nuovo picco di riflessione basale è apparso a 1,14 nm, indicando che DMSO è stato inserito con successo in interstrati Kaol. Dopo che il composto di intercalazione Kaol/DMSO è stato trattato con MeOH, il 1,14 nm (001) riflessione caratteristica del composto di intercalazione Kaol/DMSO è stato spostato a 0,86 nm. È stato riportato da Matusik et al. (2012) che il composto Kaol/DMSO/MeOH è stato essiccato a 110°C, la riflessione con d = 1,12 nm è scomparsa ed è stata osservata un’ampia riflessione con massimo a 0,95 nm. In base alla formula chimica Al2Si2O5(OH)3.20(OCH3)0.80 del composto di intercalazione Kaol/DMSO che è stato calcolato in base all’analisi CHNS, ha mostrato che circa 1/3 dei gruppi OH della superficie interna sono stati sostituiti da gruppi metossi, e questa osservazione suggerisce anche la formazione di un composto di intercalazione Kaol/MeOH (Tunney e Detellier, 1996; Cheng et al., 2015). I modelli XRD mostrano anche che i composti Kaol/MeOH intercalati con HA, DA e OA espandono la struttura lungo l’asse c, portando a una grande distanza interstrato di 2,86, 4,08 e 5,66 nm, rispettivamente. Le lunghezze delle catene molecolari di HA, DA e OA sono rispettivamente 1,56, 2,51 e 3,65 nm (McNulty et al., 2011, 2014). Nel complesso, la distanza interstrato dei composti di intercalazione Kaol/alchilamina è aumentata con la lunghezza della catena alchilica delle alchilamine, ma la molecola di alchilamina non è un singolo strato o una struttura bilayer che è perpendicolare alla superficie Kaol.
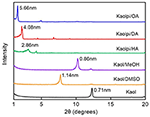
Figura 1. Schemi XRD di Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA e Kaolpi/OA.
Spettri FTIR
La spettroscopia FTIR è stata ampiamente utilizzata nella caratterizzazione dei composti di intercalazione (Ledoux e White, 1964; Frost et al., 2000c; Cheng et al., 2012). Gli spettri FTIR del Kaol originale, Kaolpi/HA, Kaolpi/DA, e Kaolpi/OA composti di intercalazione sono mostrati nella Figura 2. Le bande caratteristiche a 432, 470 e 541 cm-1 (Figura 2B) appartengono al modo di deformazione di Si-O, Si-O-Si e Al-O-Si. Le altre bande a 1.009, 1.031 e 1.114 cm-1 (Figura 2C) sono assegnate alle vibrazioni di stiramento di Si-O-Si nello strato di Kaol. Confrontando gli spettri di Kaol e dei suoi composti intercalati, la posizione delle bande non ha alcuna variazione apparente, il che indica che queste bande di vibrazioni di stiramento non sono influenzate dalle molecole intercalate.
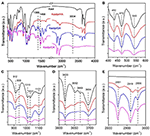
Figura 2. Spettri infrarossi di Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Le bande a 912 e 938 cm-1 (Figura 2C) appartengono alla deformazione OH dei gruppi idrossilici interni e dei gruppi idrossilici interni alla superficie. Ci sono quattro evidenti bande di stretching idrossilico a 3.694, 3.669, 3.652 e 3.620 cm-1 (Figura 2D) nello spettro del Kaol originale, le bande a 3.694, 3.669 e 3.652 cm-1 sono causate dai gruppi idrossilici interni alla superficie mentre quella a 3.620 cm-1 deriva dai gruppi idrossilici interni (Farmer, 1964; Ledoux e White, 1964; Giese e Datta, 1973). Dopo l’intercalazione delle molecole di alchilammina, alcune bande sono state indebolite a causa del cambiamento delle interazioni con gli atomi vicini. Lo spostamento a 3.697 cm-1 e la diminuzione dell’intensità della banda a 3.694 cm-1 indicano che numerosi gruppi idrossilici in Kaol hanno partecipato e formato legami a idrogeno con i gruppi amminici nelle molecole di alchilammina (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
La presenza di molecole di alchilammina interstrato è stata rilevata sullo spettro FTIR dai nuovi picchi, che sono indicati nelle figure 2A,E. Per i composti di intercalazione, alcuni picchi caratteristici evidenti come la banda a 1.388 e 1.468 cm-1 appartengono alla modalità di flessione C-H di -CH3 e -CH2, rispettivamente. È stata osservata una nuova banda di vibrazione a 3.334 cm-1 che è dovuta alla modalità di stiramento della vibrazione di stiramento N-H (Griffiths e De Haseth, 2007; Zhang et al., 2018). La nuova banda di vibrazione a 2,956 cm-1 è stata osservata e solitamente assegnata alla banda di stretching asimmetrico C-H dei gruppi metilici terminali (Cheng et al., 2016). Le due bande di vibrazione a 2.919 e 2.851 cm-1 sono solitamente assegnate alle vibrazioni di stretching simmetrico e asimmetrico del -(CH2)n- (Venkataraman e Vasudevan, 2001). L’intensità delle bande aumenta gradualmente, il che significa che più atomi di carbonio di alchilamina sono stati inseriti negli interstrati di Kaol. Inoltre, la volatilità delle alchilamine diminuisce con l’aumento della catena di carbonio, quindi la stabilità dei composti di intercalazione Kaol corrispondenti aumenterà gradualmente con una massa molecolare di alchilamina più grande (Wang et al., 2010).
Modello strutturale dei composti di intercalazione Kaol/alchilamina
La disposizione delle molecole intercalate è la base dell’analisi sperimentale della struttura del composto di intercalazione Kaol/alcilamina. Secondo Lagaly (1981), i modelli strutturali dei composti di intercalazione montmorillonite-sale di ammonio quaternario possono essere divisi in tre categorie: (a) monostrati: ioni alchilamine a catena corta; (b) bilayers: ioni di ammonio quaternario a catena lunga; (c) tre strati: catene alchiliche intrecciate in minerali argillosi altamente carichi. Beneke e Lagaly (1982) hanno inoltre proposto diverse strutture delle molecole di alchilammina intercalate sulla base della XRD, che sono riassunte come segue: (a) le catene alchiliche nello spazio intercalare sono inclinate verso il piano cristallino (001); (b) le catene alchiliche sono disposte in bilayer. Brindley e Moll (1965) hanno descritto che le molecole intercalate sono inclinate rispetto ai fogli di silicato in un singolo strato, mentre l’angolo è di circa 65° rispetto al piano del cristallo (001). Se le molecole interagenti sono uniformemente attaccate a tutte le superfici di silicato dai gruppi idrossilici attivi, si suggerisce un’organizzazione “end to end” a coppie con qualche spostamento longitudinale. L’angolo di inclinazione è in accordo con il possibile modo di impacchettamento stretto tra le superfici di ossigeno del silicato e i gruppi idrossilici terminali e il grado di impacchettamento stretto delle molecole della catena tra di loro.
Le molecole alchiliche sono difficili da intercalare direttamente gli strati originali di Kaol poiché manca di ioni scambiabili nello spazio interstrato di Kaol. Precursori validi sono essenziali quando le molecole di alchilammina si inseriscono nello strato intermedio di Kaol. È stato riportato che la catena di cloruro di ammonio trimetilico alchilico forma un bilayer inclinato nell’interstrato di Kaol e l’angolo di inclinazione è ~36° dopo il calcolo (Kuroda et al., 2011). Yuan et al. (2013) hanno sottolineato che la disposizione strutturale delle molecole di sale di ammonio quaternario nell’intercalare del bilayer inclinato di Kaol e l’angolo di inclinazione è ~38,4°. Gardolinski e Lagaly (2005) hanno proposto che le catene alchiliche negli interstrati sono completamente allungate e orientate perpendicolarmente alla superficie di Kaol dal bilayer. Pertanto, analizzando la lunghezza della catena di molecole HA, DA e OA, si può concludere che la spaziatura basale dopo l’intercalazione non è sufficiente per permettere alla catena alchilica di entrare in modo verticale e bilayer. Si può vedere analizzando ulteriormente i risultati XRD che le catene alchiliche di HA, DA e OA sono inclinate verso la superficie Kaol nel bilayer e l’angolo di inclinazione delle catene alchiliche sono circa 39.9, 39.9, 41.1°, rispettivamente. Inoltre, a causa del legame idrossilico tra l’idrossile della superficie interna nel Kaol e i gruppi amminici nelle molecole di alchilammina, il modello strutturale più possibile per i composti di intercalazione Kaol/alchilammina è mostrato nella Figura 3.
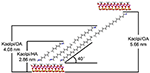
Figura 3. Il modello strutturale più possibile per i composti di intercalazione caolinite/alchilamina.
Analisi termica
I risultati dell’analisi TG-DSC del Kaol e dei suoi composti di intercalazione sono mostrati nella Figura 4. La principale perdita di massa del Kaol è quella tra 400 e 600°C con la massima perdita a 525°C attribuita alla perdita di acqua a causa della deidrossilazione del reticolo cristallino, con conseguente formazione di meta-kaolinite (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Questa perdita corrisponde a circa il 12,7% della massa totale che è estremamente vicina al riferimento teorico (13,9%). Confrontando le curve TG-DSC del Kaol originale, si osservano due fasi principali di perdita di massa nei composti di intercalazione Kaolpi/HA, Kaolpi/DA e Kaolpi/OA. La prima si è verificata tra 150 e 350°C, che è dovuta alla decomposizione delle molecole di alchilammina intercalate (Yuan et al., 2013). Il secondo si è verificato a circa 500°C ed è dovuto alla deidrossilazione del Kaol de-intercalato. Per Kaolpi/OA, alcuni OA sono stati intercalati nello spazio interstrato del silicato per formare un’intercalazione stabile, che può essere dimostrata dal modello XRD. Alcune molecole sono impigliate l’una nell’altra a causa della lunga catena o di un morsetto nei nanoscrolls che non può essere completamente rimosso (Li et al., 2015; Liu et al., 2016). A 220°C, la perdita di massa distinta è dovuta alla decomposizione dell’OA rivestito o non legato, mentre la perdita di massa a 330°C è attribuita alla decomposizione dell’OA intercalato. Il picco esotermico a 996°C è il risultato della ricristallizzazione di Kaol.
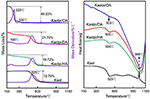
Figura 4. Curve TG-DSC per Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Confrontando le curve TG-DSC del Kaol originale e dei composti di intercalazione Kaol/alchilamina (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA), si può osservare: (a) ha diverse fasi di perdita di massa, così come una differenza significativa nelle perdite di massa tra Kaolpi/OA e gli altri due composti di intercalazione (Kaolpi/HA, Kaolpi/DA). La perdita di massa per la decomposizione di Kaolpi/HA e Kaolpi/DA era di circa il 20%, ma la quantità delle due perdite di massa per Kaolpi/OA è di circa il 50%. Questo potrebbe essere dovuto a una maggiore quantità di OA è stato intercalato nello spazio interstrato del silicato rispetto a quello HA e DA (Wang et al., 2017). (b) La temperatura di deidrossilazione dei composti di intercalazione era inferiore a quella del Kaol originale di circa 20°C. Questo perché le molecole di intercalazione hanno ampliato la spaziatura tra gli strati, hanno indebolito i legami idrogeno tra gli strati di Kaol, portando ad una più facile deidrossilazione dalla superficie di Kaol. Pertanto, la cristallinità di Kaol è fortemente diminuita dopo l’intercalazione, il che può essere confermato da XRD e IR (sotto 800 cm-1). Questo risultato è coerente con la conclusione di alcuni altri rapporti che la temperatura di deidrossilazione è stata determinata dalla cristallinità del Kaol (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Cinetiche di reazione di decomposizione
La cinetica di degradazione del composto di intercalazione Kaol/alchilammina è stata studiata con tecniche di termogravimetria. I parametri cinetici (energia di attivazione E e il fattore pre-esponenziale A) del processo di degradazione sono stati calcolati sulla base dei metodi KAS e Ozawa (Kissinger, 1957; Škvára e Šesták, 1975). Il meccanismo di degradazione termica del composto di intercalazione Kaol/alchilamina è stato studiato con il metodo integrale Satava (Xie et al., 2001; Gao et al., 2005; Zhang et al, 2015).
Secondo la teoria della reazione, la formula cinetica di decomposizione non isotermica è solitamente espressa come segue:
dove α è la misura del tasso di conversione di B(s) al tempo t, f (α) è la funzione del meccanismo di reazione, e k è la costante di velocità di reazione. k obbedisce alla seguente equazione:
Se la temperatura del campione è controllata a una velocità di riscaldamento costante (β = dT/dt), la velocità di reazione può essere definita come segue:
Dopo aver separato la variabile, riorganizzando con funzioni integrali o differenziali dell’equazione (4), l’equazione KAS (5) e l’equazione Ozawa (6) possono essere calcolate come segue:
dove G(α) rappresenta la funzione integrale di conversione. A causa dell’approssimazione integrale, i metodi iterativi sono stati utilizzati per calcolare E al fine di evitare alcune deviazioni. Le funzioni dei metodi iterativi sono le seguenti:
Posto x = E/RT, la definizione di h(x) e H(x) sono:
L’iterazione sono i seguenti tre passi:
(a) Impostare h(x) = 1 o H(x) = 1, calcolare E0 col metodo dei minimi quadrati secondo la pendenza della relazione lineare lnβ/T2 e lnβ a 1/T.
(c) Sostituire E0 con E1, ripetere il passo (b) fino a quando Ei-Ei-1 < 0. 1 kJ mol-1. Ei è il valore esatto dell’energia di attivazione della reazione di decomposizione.
I valori E dei composti di intercalazione Kaol/alchilamina sono stati calcolati con i metodi KAS, Ozawa e iterativo (Tabella 2). I risultati calcolati ottenuti con il metodo KAS erano più vicini ai risultati dei metodi iterativi, tuttavia, i risultati del metodo iterativo Ozawa hanno mostrato una maggiore deviazione dagli altri. Pertanto, la media E dei metodi iterativi può essere considerata come l’energia di attivazione della reazione di decomposizione, poiché sono un miglioramento rispetto ai metodi KAS e Ozawa. Le E medie di Kaolpi/HA, Kaolpi/DA e Kaolpi/OA sono 104,44, 130,80 e 154,59 kJ mol-1. Si può vedere che la E media tra i composti Kaol/alchilamina sono correlazione positiva con la lunghezza della catena alchilica. Uno dei motivi è che la volatilità si indebolisce al crescere della catena alchilica. Un’altra ragione è che il Kaolpi/OA possiede la migliore struttura di intercalazione ben ordinata che è la più difficile da de-intercalare. E questi risultati possono essere confermati dai modelli XRD.
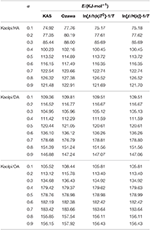
Tabella 2. E di Kaol/composti di intercalazione di alchilammina con diversi α calcolati da KAS, Ozawa, e metodi di iterazione.
Le funzioni e A del meccanismo di reazione di decomposizione è stato calcolato da metodi Satava, che è stato descritto come segue:
Sostituire α in ogni funzione di meccanismo G(α) per ottenere il valore di lg, lg di adattamento lineare, e 1/T che corrisponde al tasso di riscaldamento, la funzione che ha il più grande adattamento può essere determinata come la funzione di meccanismo più probabile. E i valori di E e A possono essere ottenuti attraverso la pendenza e l’intercetta di una curva di adattamento lineare.
Come mostrato nella tabella 3, cinque funzioni di meccanismo con bontà di adattamento superiore al 90% sono scelte in base alla formula integrale di Satava. Confrontando lì cinque funzioni, No. 9 funzione meccanismo G (α) = 2 con bontà di adattamento circa il 97% può essere considerato come la funzione meccanismo più probabile, e le curve di adattamento lineare di No. 9 funzione è stato mostrato in Figura 5. E e A sono anche nell’intervallo normale della cinetica di decomposizione. Le funzioni del meccanismo di decomposizione per i tre composti di intercalazione Kaol/alchilamina sono riportate nella Tabella 4.

Tabella 3. Funzioni selezionate del meccanismo cinetico giudicate dal metodo integrale Satava.

Figura 5. Curve di adattamento lineare della funzione No. 9 giudicata con il metodo integrale Satava.

Tabella 4. Funzioni del meccanismo cinetico dei composti di intercalazione Kaol/alchilamina.
Conclusioni
I possibili modelli di struttura e la cinetica di decomposizione dei composti di intercalazione Kaol/alchilamina sono stati studiati usando XRD, FT-IR, e TG-DSC. L’intercalazione del composto Kaol/MeOH con HA, DA, e OA espande la spaziatura interstrato di Kaol lungo l’asse c, con conseguente riflessione dominante che appare a 2.86, 4.08, e 5.66 nm, rispettivamente. Inoltre, la spaziatura basale dopo l’intercalazione non è sufficiente per permettere alla catena alchidica di entrare in modo verticale a singolo e bilayer. Si è concluso che le catene alchiliche di HA, DA e OA sono inclinate verso la superficie di Kaol nel bilayer e l’angolo di inclinazione delle catene alchiliche sono ~40°.
In base ai metodi KAS, Ozawa e iterativo, sono stati calcolati i risultati dell’energia di attivazione E dei composti di intercalazione Kaol/alchilamina. L’energia di attivazione media E di Kaolpi/HA, Kaolpi/DA e Kaolpi/OA sono 104,44, 130,80 e 154,59 kJ mol-1. L’energia di attivazione media E tra i composti Kaol/alchilamina hanno una correlazione positiva con la lunghezza della catena alchilica. La funzione di meccanismo ottimizzata del processo di decomposizione Kaol/alchilamina è stata determinata come una diffusione 3D con la funzione integrale G(α) = 2. Questa ricerca è vantaggiosa per comprendere meglio il meccanismo di decomposizione dei nanocompositi argilla/organici, oltre a fornire un’ispirazione per sintetizzare nuovi materiali a base di argilla.
Contributi degli autori
HC e QfL hanno progettato l’esperimento e rivisto il documento. YZ, QhL e PX hanno fatto gli esperimenti e scritto l’articolo. YZ e QhL hanno contribuito ugualmente a questo lavoro.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Si ringrazia il dottor Luyi Sun (Dipartimento di Ingegneria Chimica e Biomolecolare e Programma Polimeri, Istituto di Scienza dei Materiali, Università del Connecticut) per la revisione dell’articolo. Gli autori riconoscono con gratitudine il sostegno finanziario fornito dalla National Natural Science Foundation of China (41602171), la Beijing Natural Science Foundation (8164062) e lo Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing.
Giese, R., and Datta, P. (1973). Orientamento idrossile in caolinite, dickite e nacrite. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). Spettrometria infrarossa con trasformata di Fourier. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., and Guggenheim, S. (1985). Deidrossilazione di caolinite. Am. Mineral. 70, 1-2.
Google Scholar
Lascia un commento