Forze di dipolo – dipolo
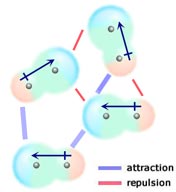
Se due molecole neutre, ciascuna con un momento di dipolo permanente, si avvicinano in modo tale che le loro estremità cariche in modo opposto si allineano, saranno attratte l’una all’altra. In un liquido o in un solido questi allineamenti sono favoriti rispetto a quelli in cui le estremità con carica simile delle molecole sono vicine e quindi si respingono a vicenda.
Una ragione per cui CH3F ha un punto di ebollizione più alto (-84 °C) rispetto a CF4 (-128 °C) è che CF3H ha un momento di dipolo permanente, mentre CF4 no. Per comprendere appieno questo è necessario sapere che CF4 è di forma tetraedrica e CH3F è approssimativamente tetraedrico (non c’è una grande differenza nelle forme di queste molecole). I legami carbonio – fluoro in entrambe le molecole sono polari (il fluoro è molto più elettronegativo del carbonio) tuttavia la presenza di quattro legami C-F nella molecola tetraedrica CF4 rende la molecola complessivamente non polare. Il momento di dipolo del singolo legame C-F in CH3F non è annullato dai dipoli del legame C-H (che sono molto piccoli) quindi CH3F ha un momento di dipolo permanente.
Un tipo di forza intermolecolare che può sorgere in particolari circostanze ed è solitamente classificata come un’interazione dipolo-dipolo, anche se ha qualche carattere di legame covalente è il legame a idrogeno.
Lascia un commento