14.8 Eteri
Obiettivi di apprendimento
- Descrivere la differenza strutturale tra un alcol e un etere che influenza le caratteristiche fisiche e la reattività di ciascuno.
- Nominare eteri semplici.
- Descrivere la struttura e gli usi di alcuni eteri.
Con la formula generale ROR′, un etereUn composto organico che ha un atomo di ossigeno tra due gruppi idrocarburici. può essere considerato un derivato dell’acqua in cui entrambi gli atomi di idrogeno sono sostituiti da gruppi alchilici o arilici. Può anche essere considerato un derivato di un alcool (ROH) in cui l’atomo di idrogeno del gruppo OH è stato sostituito da un secondo gruppo alchilico o arilico:
HOH→ atomi di H sostituiscono entrambi gli atomi di ROR′← del gruppo OH sostituiscono l’atomo di HROH
Gli eteri semplici hanno nomi comuni semplici, formati dai nomi dei gruppi attaccati all’atomo di ossigeno, seguito dal nome generico etere. Per esempio, CH3-O-CH2CH2CH3 è il metilpropil etere. Se entrambi i gruppi sono uguali, il nome del gruppo deve essere preceduto dal prefisso di-, come in dimetil etere (CH3-O-CH3) e dietil etere CH3CH2-O-CH2CH3.
Le molecole di etere non hanno atomi di idrogeno sull’atomo di ossigeno (cioè, nessun gruppo OH). Non c’è quindi alcun legame idrogeno intermolecolare tra le molecole di etere, e gli eteri hanno quindi punti di ebollizione piuttosto bassi per una data massa molare. Infatti, gli eteri hanno punti di ebollizione circa uguali a quelli degli alcani di massa molare comparabile e molto più bassi di quelli degli alcoli corrispondenti (Tabella 14.4 “Confronto dei punti di ebollizione di alcani, alcoli ed eteri”).
Tabella 14.4 Confronto dei punti di ebollizione di alcani, alcoli ed eteri
| Formula strutturale condensata | Nome | Massa molare | Punto di ebollizione (°C) | Legame idrogeno intermolecolare nel liquido puro? |
|---|---|---|---|---|
| CH3CH2CH3 | propano | 44 | -42 | no |
| CH3OCH3 | etere dimetilico | 46 | -25 | no |
| CH3CH2OH | alcol etilico | 46 | 78 | si |
| CH3CH2CH2CH2CH3 | pentano | 72 | 36 | no |
| CH3CH2OCH2CH3 | etere dietetico | 74 | 35 | no |
| CH3CH2CH2CH2OH | alcool butilico | 74 | 117 | si |
Le molecole di etere hanno un atomo di ossigeno, tuttavia, e si legano a idrogeno con le molecole d’acqua. Di conseguenza, un etere ha circa la stessa solubilità in acqua dell’alcol che è isomerico con esso. Per esempio, l’etere dimetilico e l’etanolo (entrambi con formula molecolare C2H6O) sono completamente solubili in acqua, mentre l’etere dietilico e l’1-butanolo (entrambi C4H10O) sono appena solubili in acqua (8 g/100 mL di acqua).
Esempio 5
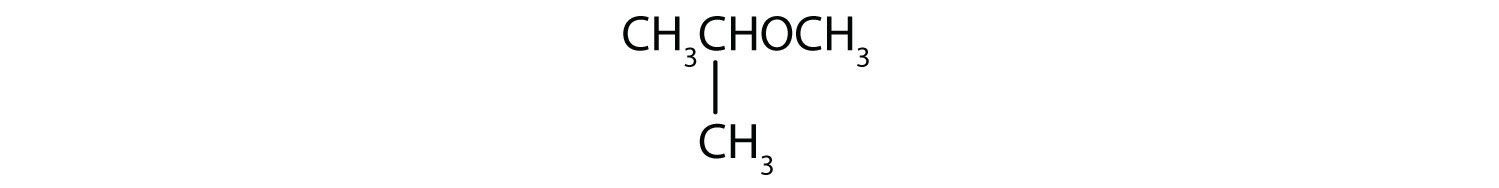
Qual è il nome comune di ogni etere?
- CH3CH2CH2OCH2CH2CH3
-
Soluzione
- I gruppi di carbonio su entrambi i lati dell’atomo di ossigeno sono gruppi propilici (CH3CH2CH2), quindi il composto è dipropil etere.
- Il gruppo a tre carboni è attaccato dall’atomo di carbonio centrale, quindi è un gruppo isopropilico. Il gruppo a un carbonio è un gruppo metile. Il composto è l’etere isopropilico di metile.
Esercizio di costruzione di abilità
-
CH3CH2CH2CH2OCH2CH2CH2CH3
-
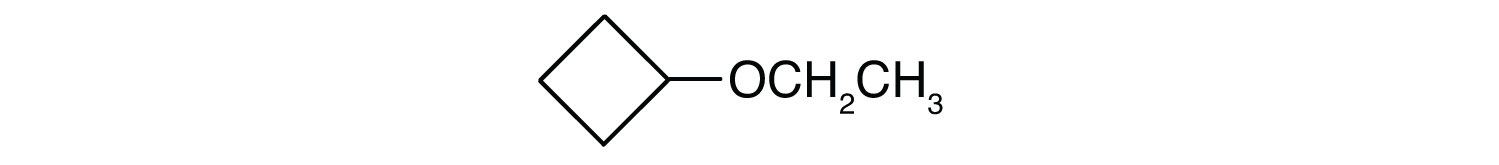
Qual è il nome comune di ogni etere?
alla salute: Eteri come Anestetici Generali
Un anestetico generale agisce sul cervello per produrre incoscienza e una generale insensibilità alle sensazioni o al dolore. L’etere dietilico (CH3CH2OCH2CH3) fu il primo anestetico generale ad essere usato.
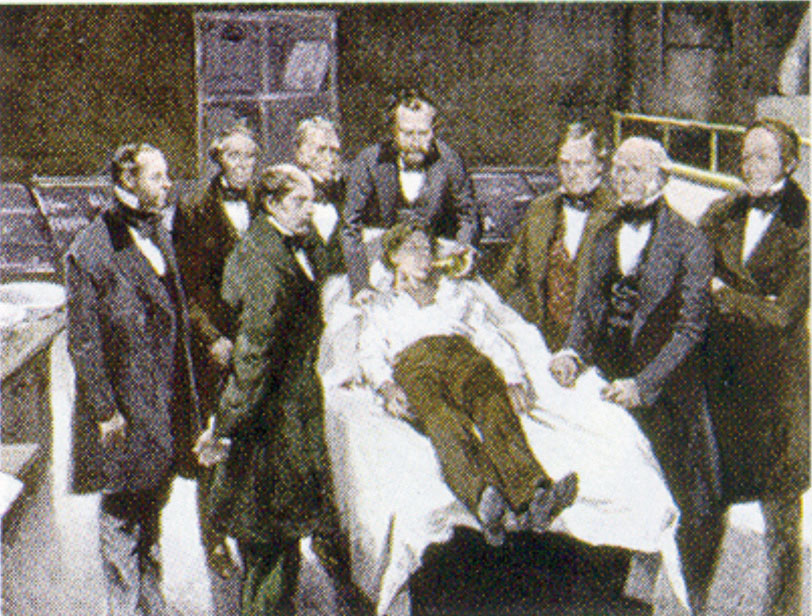
William Morton, un dentista di Boston, introdusse l’etere dietilico nella pratica chirurgica nel 1846. Questo dipinto mostra un’operazione a Boston nel 1846 in cui l’etere dietilico fu usato come anestetico. L’inalazione di vapori di etere produce incoscienza deprimendo l’attività del sistema nervoso centrale.
Fonte: Pittura di William Morton di Ernest Board, da http://commons.wikimedia.org/wiki/File:Morton_Ether_1846.jpg.
L’etere dietilico è relativamente sicuro perché c’è un divario abbastanza ampio tra la dose che produce un livello efficace di anestesia e la dose letale. Tuttavia, poiché è altamente infiammabile e ha l’ulteriore svantaggio di causare nausea, è stato sostituito da anestetici inalatori più recenti, compresi i composti contenenti fluoro: alotano, enflurano e isoflurano. Sfortunatamente, la sicurezza di questi composti per il personale di sala operatoria è stata messa in discussione. Per esempio, le lavoratrici di sala operatoria esposte all’alotano soffrono di un più alto tasso di aborti spontanei rispetto alle donne della popolazione generale.
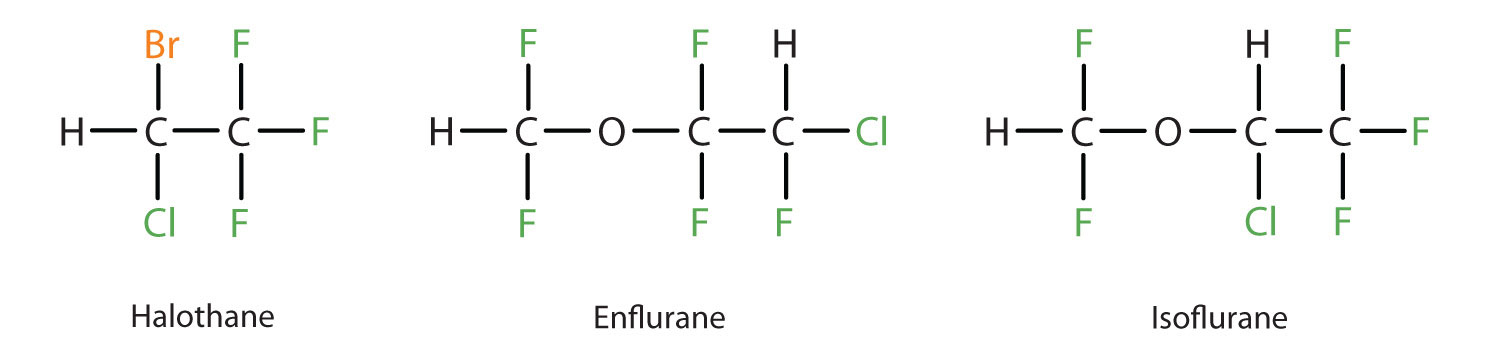
Questi tre moderni composti anestetici, inalanti, contenenti alogeni, sono meno infiammabili dell’etere dietilico.
Esercizi di revisione del concetto
-
Perché l’etere dietilico (CH3CH2OCH2CH3) ha un punto di ebollizione molto più basso dell’1-butanolo (CH3CH2CH2CH2OH)?
-
Qual è più solubile in acqua – etere etilico (CH3CH2OCH3) o 1-butanolo (CH3CH2CH2CH2OH)? Spiegare.
Risposte
-
L’etere etilico non ha legame idrogeno intermolecolare perché non c’è un gruppo OH; l’1-butanolo ha un OH e si impegna nel legame idrogeno intermolecolare.
-
L’etere etilico metilico (tre atomi di carbonio, un atomo di ossigeno) è più solubile in acqua dell’1-butanolo (quattro atomi di carbonio, un atomo di ossigeno), anche se entrambi possono legarsi a idrogeno con l’acqua.
Punti chiave
- Per dare nomi comuni agli eteri, basta nominare i gruppi attaccati all’atomo di ossigeno, seguiti dal nome generico etere. Se entrambi i gruppi sono uguali, il nome del gruppo dovrebbe essere preceduto dal prefisso di-.
- Le molecole di etere non hanno gruppo OH e quindi nessun legame idrogeno intermolecolare. Gli eteri hanno quindi punti di ebollizione piuttosto bassi per una data massa molare.
- Le molecole di etere hanno un atomo di ossigeno e possono impegnarsi nel legame a idrogeno con le molecole di acqua. Una molecola di etere ha circa la stessa solubilità in acqua dell’alcool che è isomerico con essa.
Esercizi
-
Come può l’etanolo dare due prodotti diversi quando viene riscaldato con acido solforico? Nominare questi prodotti.
-
Quale di questi eteri è isomerico con l’etanolo-CH3CH2OCH2CH3, CH3OCH2CH3 o CH3OCH3?
-
Nominare ogni composto.
- CH3OCH2CH2CH3
-
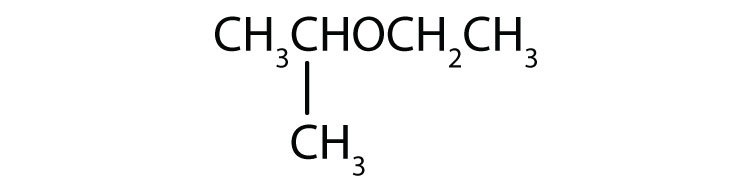
-
Nominare ogni composto.
- CH3CH2CH2CH2OCH3
- CH3CH2OCH2CH2CH3
-
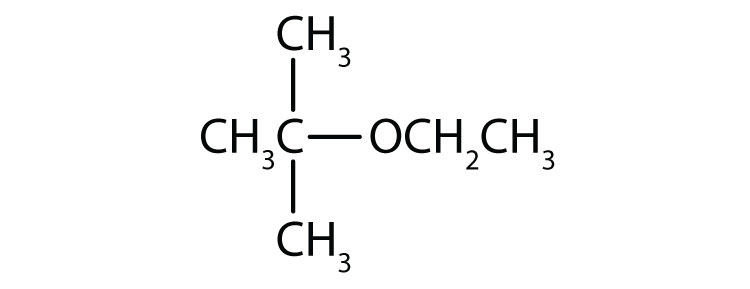
Disegna la struttura di ogni composto.
- etere etilico metilico
- etere etilico tert-butilico
-
Disegna la struttura per ogni composto.
- diisopropil etere
- ciclopropil propil etere
Risposte
-
La disidratazione intramolecolare (sia l’H che l’OH vengono dalla stessa molecola) dà etilene; la disidratazione intermolecolare (l’H proviene da una molecola e l’OH da un’altra molecola) dà l’etere dietilico.
-
- etere propilico metile
- etere isopropilico
-
- CH3OCH2CH3
-
Lascia un commento