Gli elementi del gruppo 13 includono i metalli post-transizione.
Il termine metalli post-transizione si riferisce a quegli elementi che sono metalli dopo i metalli di transizione. Come per il concetto di metalloide, non c’è un consenso universale su cosa sia esattamente un metallo post-transizione. Fortunatamente, nella pratica è meno importante definire con precisione ciò che è e non è un metallo di post-transizione che capire il motivo per cui potrebbe essere utile classificare gli elementi come un metallo di post-transizione.
Le caratteristiche principali dei metalli di post transizione sono che sono relativamente ricchi di elettroni ed elettronegativi rispetto a ciò che classicamente si pensa come un metallo. Approssimativamente, questo si traduce in punti di fusione relativamente più bassi (dal momento che più livelli anti-leganti nella struttura della banda tendono ad essere occupati), maggiore preferenza per la covalenza, e maggiore fragilità rispetto ad altri metalli (a causa del legame direzionale risultante). La loro ricchezza di elettroni significa che tendono a formare cationi morbidi.
Diversi sistemi sono usati per classificare gli elementi come appartenenti ai metalli post transizione. I principali includono:
- Metalli che seguono il blocco d. Con questa definizione sono inclusi solo i metalli dei gruppi 13 e superiori e delle file 3 e superiori che formano cationi relativamente morbidi e ricchi di elettroni e mostrano una significativa covalenza nel loro legame. Tuttavia, se questo schema viene adottato troppo rigidamente, l’Al è escluso poiché tecnicamente non segue il blocco d (e ha un sottoguscio (n-1)d non riempito) e i metalloidi sono esclusi, anche se molti di loro formano anche cationi relativamente morbidi e ricchi di elettroni con sottogusci (n-1)d riempiti. Un altro svantaggio di questo sistema è che ingarbuglia la questione di quali elementi dovrebbero essere classificati come metalli post-transizione con la spinosa questione di quali elementi dovrebbero essere classificati come metalli contro metalloidi.
- Metalli e metalloidi del blocco p. Questo sistema ha il vantaggio di enfatizzare le proprietà interessanti e uniche dei metalli e dei metalloidi del blocco p così come le continuità in quelle proprietà attraverso il blocco p. Di conseguenza, sarà usato nelle sezioni che seguono. Tuttavia, ha lo svantaggio di escludere metalli come Zn, Cd e Hg, che formano molti composti in cui il metallo ha una configurazione (n-1)d10.
- I metalli che seguono gli elementi di transizione nel senso di formare ioni con un guscio di valenza completamente pieno (n-1)d a volte insieme ad Al e i metalloidi del blocco p. Questa definizione aggiunge Zn, Cd e Hg (e talvolta Cu, Ag e Au) poiché formano ioni con una configurazione di elettroni di valenza (n-1)d 10 come Zn2+, Cd2+ e Hg2+ (e Cu+, Ag+ e Au+). Poiché questo capitolo considera solo gli elementi del blocco p per gli scopi di questo capitolo questo sistema è funzionalmente identico al sistema 2.
Qualunque schema di classificazione si usi è spesso più utile pensare alla classificazione degli elementi come metalli di post-transizione come un modo per sottolineare le somiglianze nelle proprietà chimiche di un insieme di elementi che come un modo per sottolineare come i metalli di post-transizione differiscono dagli altri metalli. I metalli post-transizione non sono gli unici che formano cationi molli o composti meglio descritti come tenuti insieme da legami covalenti. Come le sezioni precedenti hanno chiarito, anche i metalli alcalini formano anioni nelle giuste circostanze e molti composti di metalli sono meglio descritti in termini di covalenza che di interazioni ioniche. Questo era già evidente nella chimica dei metalli alcalino-terrosi Be e Mg discussa nella sezione precedente. Nei capitoli successivi il legame e la reattività nei complessi di coordinazione e nei composti organometallici saranno ampiamente descritti in termini covalenti.
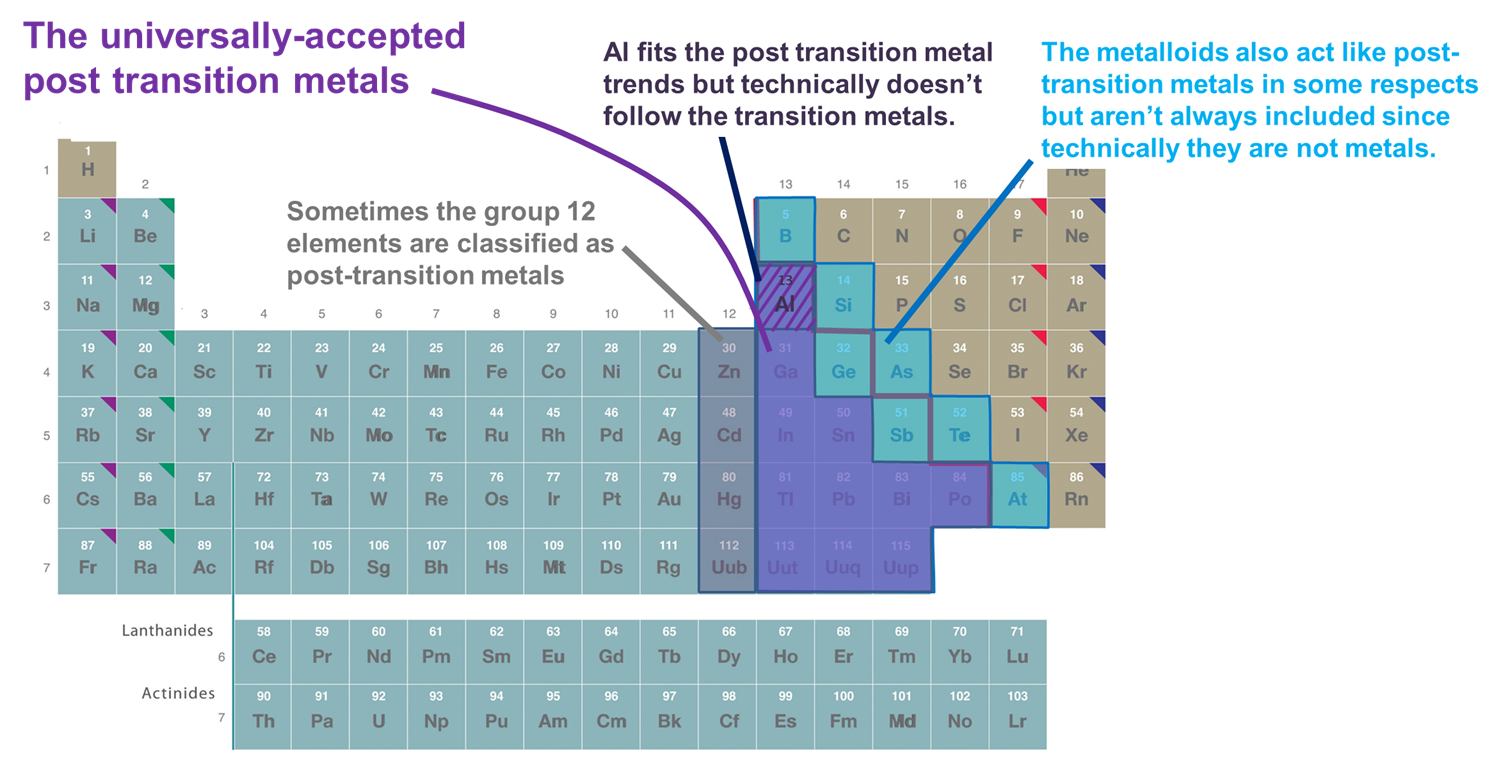
Figura \sf{PageIndex{2}}. Alcuni degli elementi classificati come metalli di post transizione. Quelli mostrati in viola sono comunemente accettati in quanto sono metalli e seguono chiaramente i metalli di transizione, mentre i metalli del gruppo 12 (e talvolta 11), Al, e i metalloidi sono tutti talvolta inclusi in quanto si comportano come gli altri metalli post-transizione in aspetti importanti. La tavola periodica è adattata da quella di https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atomi%2C_Molecole%2C_e_Ioni/2.5%3A_La_Tabella_Periodica.
Lascia un commento