Momenti di dipolo molecolari
Nelle molecole che contengono più di un legame polare, il momento di dipolo molecolare è solo la combinazione vettoriale di quelli che possono essere considerati come singoli “momenti di dipolo di legame”. Matematicamente, i momenti di dipolo sono vettori; possiedono sia una grandezza che una direzione. Il momento di dipolo di una molecola è quindi la somma vettoriale dei momenti di dipolo dei singoli legami nella molecola. Se i momenti di dipolo dei singoli legami si annullano a vicenda, non c’è alcun momento di dipolo netto. Questo è il caso della CO2, una molecola lineare (Figura \PageIndex{1a}). Ogni legame C-O nella CO2 è polare, eppure gli esperimenti mostrano che la molecola di CO2 non ha momento di dipolo. Poiché i due dipoli del legame C-O nella CO2 sono uguali in grandezza e orientati a 180° l’uno dall’altro, si annullano. Di conseguenza, la molecola di CO2 non ha un momento di dipolo netto anche se ha una sostanziale separazione di carica. Al contrario, la molecola di H2O non è lineare (Figura \PageIndex{1b}); è piegata nello spazio tridimensionale, quindi i momenti di dipolo non si annullano a vicenda. Così una molecola come H2O ha un momento di dipolo netto. Ci aspettiamo che la concentrazione di carica negativa sia sull’ossigeno, l’atomo più elettronegativo, e la carica positiva sui due idrogeni. Questa polarizzazione di carica permette all’H2O di legarsi ad altre specie polarizzate o cariche, incluse altre molecole d’acqua.
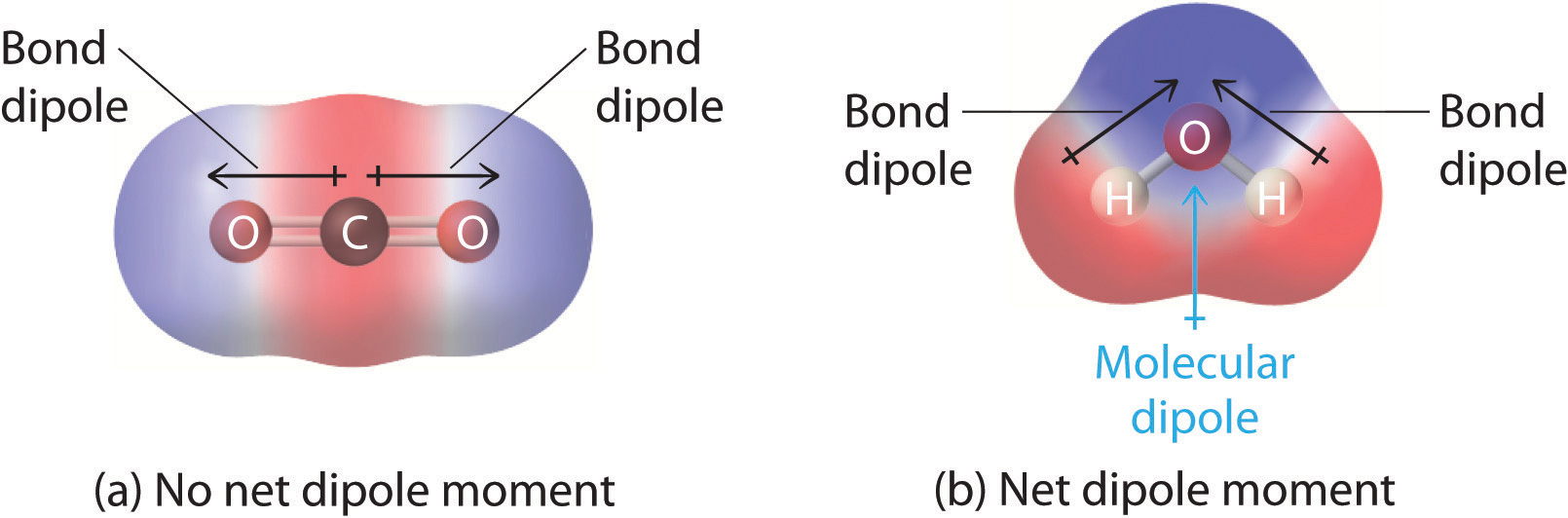
Figura \(\PageIndex{1}}): Come i singoli momenti di dipolo di legame sono sommati per dare un momento di dipolo molecolare complessivo per due molecole triatomiche con strutture diverse. (a) In CO2, i dipoli di legame C-O sono uguali in grandezza ma orientati in direzioni opposte (a 180°). La loro somma vettoriale è zero, quindi la CO2 non ha dipoli netti. (b) In H2O, i dipoli del legame O-H sono anche uguali in grandezza, ma sono orientati a 104,5° tra loro. Quindi la somma vettoriale non è zero, e H2O ha un momento di dipolo netto.
La seguente è un’equazione semplificata per un semplice sistema a due cariche separate che è presente nelle molecole biatomiche o quando si considera un dipolo di legame all’interno di una molecola.
Questo dipolo di legame, µ (mu greco) è interpretato come il dipolo da una separazione di carica su una distanza \(r\) tra le cariche parziali \(Q^+\) e \(Q^-\) (o i termini più comunemente usati \(δ^+\) – \(δ^-\)); l’orientamento del dipolo è lungo l’asse del legame. Le unità dei momenti di dipolo sono tipicamente i debyes (D) dove un debye è uguale a 3,336 x 1030 metri coulomb (C – m) in unità SI. Consideriamo un semplice sistema di un singolo elettrone e protone separati da una distanza fissa. La carica unitaria di un elettrone è 1,60 X 1019 C e il protone &elettrone sono distanti 100 pm (circa la lunghezza di un tipico legame covalente), il momento di dipolo è calcolato come:
\ &= (1,60 \volte 10^{-19} C)(1,00 \volte 10^{-10} \,m) \non numero \\ &= 1,60 \volte 10^{-29} \C \cdot m \etichetta 2
&= 4,80\; D \label{3}
(4,80; D) è un valore di riferimento chiave e rappresenta una carica pura di +1 e -1 separati da 100 pm. Tuttavia, se la separazione di carica fosse aumentata, il momento di dipolo aumenterebbe (linearmente):
- Se il protone e l’elettrone fossero separati da 120 pm:
- Se il protone e l’elettrone fossero separati da 150 pm:
- Se il protone e l’elettrone fossero separati da 200 pm:
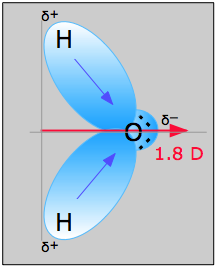
Esempio \(\PageIndex{1}\): Acqua
La molecola d’acqua nella figura \(\PageIndex{1}}) può essere usata per determinare la direzione e la grandezza del momento di dipolo. Dalle elettronegatività dell’ossigeno e dell’idrogeno, la differenza è 1,2e per ciascuno dei legami idrogeno-ossigeno. Poi, poiché l’ossigeno è l’atomo più elettronegativo, esercita una maggiore attrazione sugli elettroni condivisi; ha anche due coppie solitarie di elettroni. Da questo, si può concludere che il momento di dipolo punta da tra i due atomi di idrogeno verso l’atomo di ossigeno. Usando l’equazione di cui sopra, si calcola che il momento di dipolo sia 1,85 D moltiplicando la distanza tra gli atomi di ossigeno e idrogeno per la differenza di carica tra di loro e trovando poi le componenti di ciascuna che puntano nella direzione del momento di dipolo netto (l’angolo della molecola è 104.5˚).
Il momento di legame del legame O-H =1,5 D, quindi il momento di dipolo netto è
\
Lascia un commento