Sostanze e miscele pure
Una sostanza chimica pura è qualsiasi materia che ha una composizione chimica fissa e proprietà caratteristiche. L’ossigeno, per esempio, è una sostanza chimica pura che è un gas incolore e inodore a 25°C. Pochissimi campioni di materia sono costituiti da sostanze pure; invece, la maggior parte sono miscele, che sono combinazioni di due o più sostanze pure in proporzioni variabili in cui le singole sostanze mantengono la loro identità. L’aria, l’acqua del rubinetto, il latte, il formaggio erborinato, il pane e lo sporco sono tutte miscele. Se tutte le porzioni di un materiale sono nello stesso stato, non hanno confini visibili e sono uniformi, allora il materiale è omogeneo. Esempi di miscele omogenee sono l’aria che respiriamo e l’acqua del rubinetto che beviamo. Le miscele omogenee sono anche chiamate soluzioni. Così l’aria è una soluzione di azoto, ossigeno, vapore acqueo, anidride carbonica e diversi altri gas; l’acqua del rubinetto è una soluzione di piccole quantità di diverse sostanze in acqua. Le composizioni specifiche di entrambe queste soluzioni non sono fisse, tuttavia, ma dipendono sia dalla fonte che dal luogo; per esempio, la composizione dell’acqua di rubinetto a Boise, Idaho, non è la stessa di quella di Buffalo, New York. Anche se la maggior parte delle soluzioni che incontriamo sono liquide, le soluzioni possono anche essere solide. La sostanza grigia ancora usata da alcuni dentisti per riempire le cavità dei denti è una soluzione solida complessa che contiene il 50% di mercurio e il 50% di una polvere che contiene soprattutto argento, stagno e rame, con piccole quantità di zinco e mercurio. Le soluzioni solide di due o più metalli sono comunemente chiamate leghe.
Se la composizione di un materiale non è completamente uniforme, allora è eterogenea (ad esempio, pasta per biscotti al cioccolato, formaggio blu e sporcizia). Le miscele che sembrano essere omogenee si rivelano spesso eterogenee dopo un esame microscopico. Il latte, per esempio, sembra essere omogeneo, ma quando viene esaminato al microscopio, è chiaramente costituito da minuscoli globuli di grasso e proteine dispersi in acqua. I componenti di miscele eterogenee possono solitamente essere separati con mezzi semplici. Miscele solido-liquido come la sabbia in acqua o le foglie di tè nel tè sono facilmente separate per filtrazione, che consiste nel far passare la miscela attraverso una barriera, come un filtro, con fori o pori più piccoli delle particelle solide. In linea di principio, le miscele di due o più solidi, come lo zucchero e il sale, possono essere separate mediante ispezione microscopica e selezione. Di solito, però, sono necessarie operazioni più complesse, come quando si separano le pepite d’oro dalla ghiaia del fiume con il panning. Prima il materiale solido viene filtrato dall’acqua del fiume; poi i solidi vengono separati tramite ispezione. Se l’oro è incorporato nella roccia, può essere isolato con metodi chimici.
-and-Milk-(left).jpg?revision=1)
Figura 1.2.2: Una miscela eterogenea. Al microscopio, il latte intero è in realtà una miscela eterogenea composta da globuli di grasso e proteine dispersi in acqua. Figura usata con il permesso di Wikipedia
Miscele omogenee (soluzioni) possono essere separate nelle sostanze che le compongono mediante processi fisici che si basano sulle differenze in alcune proprietà fisiche, come le differenze nei loro punti di ebollizione. Due di questi metodi di separazione sono la distillazione e la cristallizzazione. La distillazione fa uso delle differenze di volatilità, una misura di quanto facilmente una sostanza si converte in un gas ad una data temperatura. Un semplice apparato di distillazione per separare una miscela di sostanze, almeno una delle quali è un liquido. Il componente più volatile bolle per primo e si condensa di nuovo in un liquido nel condensatore raffreddato ad acqua, dal quale fluisce nel pallone ricevente. Se una soluzione di sale e acqua viene distillata, per esempio, il componente più volatile, l’acqua pura, si raccoglie nel pallone ricevente, mentre il sale rimane nel pallone di distillazione.

Figura 1.2.3: La distillazione di una soluzione di sale da cucina in acqua. La soluzione di sale in acqua viene riscaldata nel pallone di distillazione fino all’ebollizione. Il vapore risultante si arricchisce del componente più volatile (acqua), che condensa in un liquido nel condensatore freddo e viene poi raccolto nel pallone ricevente.
Miscele di due o più liquidi con diversi punti di ebollizione possono essere separate con un apparato di distillazione più complesso. Un esempio è la raffinazione del petrolio greggio in una gamma di prodotti utili: carburante per l’aviazione, benzina, cherosene, carburante diesel e olio lubrificante (nell’ordine approssimativo di volatilità decrescente). Un altro esempio è la distillazione di alcolici come il brandy o il whiskey. Questa procedura relativamente semplice ha causato più di qualche mal di testa alle autorità federali negli anni ’20 durante l’era del proibizionismo, quando gli alambicchi illegali proliferavano in regioni remote degli Stati Uniti.
La cristallizzazione separa le miscele in base alle differenze di solubilità, una misura di quanta sostanza solida rimane dissolta in una data quantità di un liquido specifico. La maggior parte delle sostanze sono più solubili a temperature più alte, quindi una miscela di due o più sostanze può essere sciolta a una temperatura elevata e poi lasciata raffreddare lentamente. In alternativa, il liquido, chiamato solvente, può essere lasciato evaporare. In entrambi i casi, la meno solubile delle sostanze disciolte, quella che ha meno probabilità di rimanere in soluzione, di solito forma prima i cristalli, e questi cristalli possono essere rimossi dalla soluzione rimanente per filtrazione.

Figura 1.2.4: La cristallizzazione dell’acetato di sodio da una soluzione concentrata di acetato di sodio in acqua. L’aggiunta di un piccolo cristallo “seme” (a) fa sì che il composto formi cristalli bianchi, che crescono e alla fine occupano la maggior parte della beuta. Il video può essere trovato qui: https://www.youtube.com/watch?v=BLq5NibwV5g
La maggior parte delle miscele possono essere separate in sostanze pure, che possono essere elementi o composti. Un elemento, come il sodio grigio e metallico, è una sostanza che non può essere scomposta in altre più semplici tramite cambiamenti chimici; un composto, come il cloruro di sodio bianco e cristallino, contiene due o più elementi e ha proprietà chimiche e fisiche che sono solitamente diverse da quelle degli elementi di cui è composto. Con poche eccezioni, un particolare composto ha la stessa composizione elementare (gli stessi elementi nelle stesse proporzioni) indipendentemente dalla sua origine o storia. La composizione chimica di una sostanza viene alterata in un processo chiamato cambiamento chimico. La conversione di due o più elementi, come il sodio e il cloro, in un composto chimico, il cloruro di sodio, è un esempio di cambiamento chimico, spesso chiamato reazione chimica. Attualmente, circa 115 elementi sono conosciuti, ma milioni di composti chimici sono stati preparati da questi 115 elementi. Gli elementi conosciuti sono elencati nella tavola periodica.
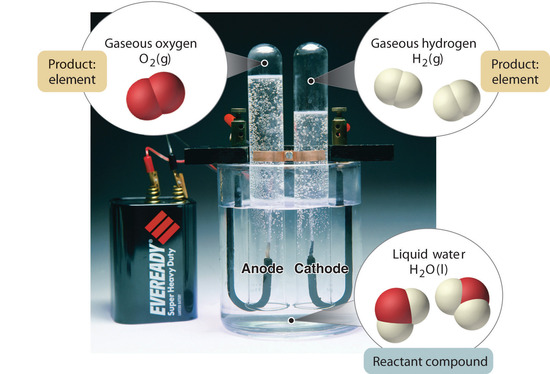
Figura 1.2.5: La decomposizione dell’acqua in idrogeno e ossigeno per elettrolisi. L’acqua è un composto chimico; idrogeno e ossigeno sono elementi.
In generale, un processo chimico inverso scompone i composti nei loro elementi. Per esempio, l’acqua (un composto) può essere decomposta in idrogeno e ossigeno (entrambi elementi) con un processo chiamato elettrolisi. Nell’elettrolisi, l’elettricità fornisce l’energia necessaria per separare un composto nei suoi elementi costitutivi (Figura 1.2.5). Una tecnica simile è usata su vasta scala per ottenere alluminio puro, un elemento, dai suoi minerali, che sono miscele di composti. Poiché è necessaria una grande quantità di energia per l’elettrolisi, il costo dell’elettricità è di gran lunga la spesa maggiore sostenuta nella produzione di alluminio puro. Quindi il riciclaggio dell’alluminio è sia conveniente che ecologico. L’organizzazione generale della materia e i metodi usati per separare le miscele sono riassunti nella figura 1.2.6.
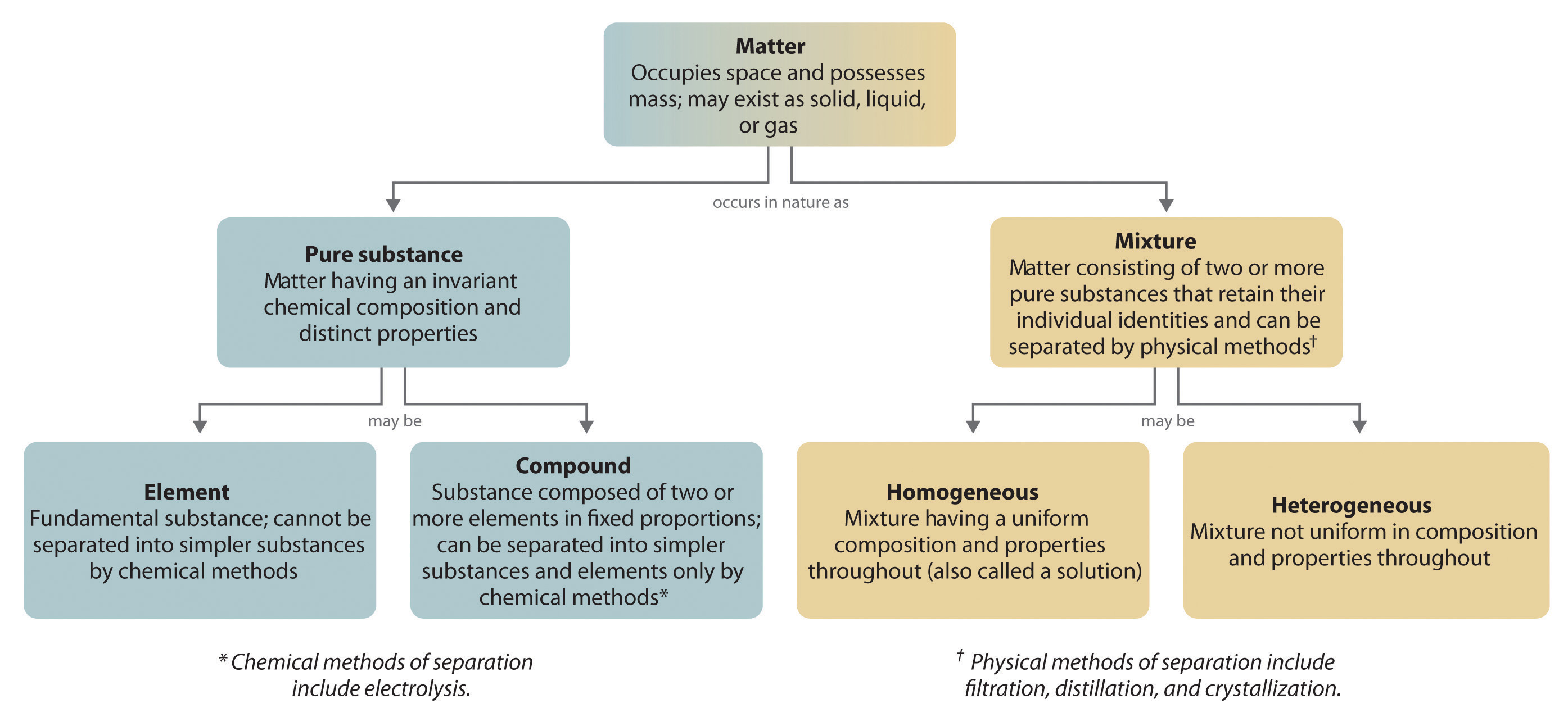
Figura 1.2.6: Relazioni tra i tipi di materia e i metodi usati per separare le miscele
Esempio 1.2.1
Identifica ogni sostanza come un composto, un elemento, una miscela eterogenea o una miscela omogenea (soluzione).
- tè filtrato
- succo d’arancia appena spremuto
- un compact disc
- ossido di alluminio, una polvere bianca che contiene un rapporto 2:3 di atomi di alluminio e ossigeno
- selenio
Data: una sostanza chimica
Chiesto: la sua classificazione
Strategia:
- Decidere se una sostanza è chimicamente pura. Se è pura, la sostanza è un elemento o un composto. Se una sostanza può essere separata nei suoi elementi, è un composto.
- Se una sostanza non è chimicamente pura, è una miscela eterogenea o una miscela omogenea. Se la sua composizione è uniforme in tutto, è un miscuglio omogeneo.
Soluzione:
- Un tè è una soluzione di composti in acqua, quindi non è chimicamente puro. Di solito viene separato dalle foglie di tè per filtrazione. B Perché la composizione della soluzione è uniforme in tutto, è una miscela omogenea.
- A Il succo d’arancia contiene particelle di solido (polpa) e di liquido; non è chimicamente puro. B Poiché la sua composizione non è uniforme in tutto, il succo d’arancia è una miscela eterogenea.
- A Un compact disc è un materiale solido che contiene più di un elemento, con regioni di composizioni diverse visibili lungo il suo bordo. Quindi un compact disc non è chimicamente puro. B Le regioni di composizione diversa indicano che un compact disc è una miscela eterogenea.
- A L’ossido di alluminio è un composto singolo, chimicamente puro.
- A Il selenio è uno degli elementi noti.
Esercizio 1.2.1
Identifica ogni sostanza come un composto, un elemento, una miscela eterogenea o una miscela omogenea (soluzione).
- vino bianco
- mercurio
- concetto per insalate
- zucchero da tavola (saccarosio)
Risposta:
- soluzione
- elemento
- miscela eterogenea
- composto
Sommario
La materia può essere classificata secondo proprietà fisiche e chimiche. La materia è tutto ciò che occupa spazio e ha massa. I tre stati della materia sono solido, liquido e gas. Un cambiamento fisico comporta la conversione di una sostanza da uno stato di materia ad un altro, senza cambiare la sua composizione chimica. La maggior parte della materia consiste in miscele di sostanze pure, che possono essere omogenee (composizione uniforme) o eterogenee (regioni diverse possiedono composizioni e proprietà diverse). Le sostanze pure possono essere composti chimici o elementi. I composti possono essere scomposti in elementi mediante reazioni chimiche, ma gli elementi non possono essere separati in sostanze più semplici con mezzi chimici. Le proprietà delle sostanze possono essere classificate come fisiche o chimiche. Gli scienziati possono osservare le proprietà fisiche senza cambiare la composizione della sostanza, mentre le proprietà chimiche descrivono la tendenza di una sostanza a subire cambiamenti chimici (reazioni chimiche) che cambiano la sua composizione chimica. Le proprietà fisiche possono essere intensive o estensive. Le proprietà intensive sono le stesse per tutti i campioni, non dipendono dalla dimensione del campione e includono, per esempio, il colore, lo stato fisico e i punti di fusione e di ebollizione. Le proprietà estensive dipendono dalla quantità di materiale e includono la massa e il volume. Il rapporto tra due proprietà estensive, massa e volume, è un’importante proprietà intensiva chiamata densità.
Contribuenti
Modificato da Joshua Halpern (Howard University)
Lascia un commento