|
|
Ebben a cikkben több probléma is van. Kérjük, segítsen javítani, vagy vitassa meg ezeket a problémákat a beszélgetés oldalon. (Tudja meg, hogyan és mikor távolítsa el ezeket a sablonüzeneteket)
(Learn how and when to remove this template message) |
A monoszacharidok (a görög monos: egyetlen, sacchar: cukor), más néven egyszerű cukrok, a cukor legegyszerűbb formája és a szénhidrátok legalapvetőbb egységei (monomerei). Általános képletük: C
nH
2nO
n, bár nem minden erre a képletre illeszkedő molekula (pl. az ecetsav) szénhidrát. Általában színtelen, vízben oldódó, kristályos szilárd anyagok. Nevükkel (cukrok) ellentétben csak néhány monoszacharidnak van édes íze.
A monoszacharidok közé tartozik például a glükóz (dextróz), a fruktóz (levulóz) és a galaktóz. A monoszacharidok a diszacharidok (például a szacharóz és a laktóz) és a poliszacharidok (például a cellulóz és a keményítő) építőkövei. Minden szénatom, amely hidroxilcsoportot hordoz, királis, kivéve a lánc végén lévőket. Ez számos izomer formát eredményez, amelyek mindegyike azonos kémiai képlettel rendelkezik. Például a galaktóz és a glükóz mindkettő aldihexóz, de eltérő fizikai szerkezettel és kémiai tulajdonságokkal rendelkeznek.
A monoszacharid glükóz központi szerepet játszik az anyagcserében, ahol a kémiai energiát a glikolízis és a citromsavciklus segítségével nyerik ki, hogy energiát biztosítsanak az élő szervezeteknek. Néhány más monoszacharid az élő szervezetben glükózzá alakítható.
Szerkezet és nómenklatúra
A monoszacharidok néhány kivételtől eltekintve (pl. dezoxiribóz) ezzel a kémiai képlettel rendelkeznek: (CH2O)x, ahol egyezményesen x ≥ 3. A monoszacharidok a bennük lévő szénatomok x száma alapján osztályozhatók: trióz (3), tetróz (4), pentóz (5), hexóz (6), heptóz (7) stb.
A glükóz, amelyet energiaforrásként és a keményítő, glikogén és cellulóz szintéziséhez használnak, hexóz. A ribóz és a dezoxiribóz (az RNS-ben, illetve a DNS-ben) pentózcukrok. A heptózok közé tartoznak például a ketózok, a mannoheptulóz és a szedoheptulóz. A nyolc vagy több szénatomot tartalmazó monoszacharidok ritkán figyelhetők meg, mivel meglehetősen instabilak. Vizes oldatokban a monoszacharidok gyűrűként léteznek, ha négynél több szénatomjuk van.
Lineáris láncú monoszacharidok
Az egyszerű monoszacharidok lineáris és elágazás nélküli szénvázzal rendelkeznek, egy karbonil (C=O) funkciós csoporttal, és egy hidroxil (OH) csoporttal a többi szénatomon. Ezért az egyszerű monoszacharid molekulaszerkezete a következőképpen írható fel: H(CHOH)n(C=O)(CHOH)mH, ahol n + 1 + m = x; így az elemi képlete: CxH2xOx.
Egyezmény szerint a szénatomokat 1-től x-ig számozzuk a gerinc mentén, a C=O csoporthoz legközelebb eső végtől kezdve. A monoszacharidok a szénhidrátok legegyszerűbb egységei és a cukor legegyszerűbb formája.
Ha a karbonil az 1-es pozícióban van (azaz n vagy m nulla), a molekula H(C=O)- formilcsoporttal kezdődik, és technikailag aldehidnek számít. Ebben az esetben a vegyületet aldóznak nevezzük. Ellenkező esetben a molekula két szénatom között egy ketocsoportot, egy -(C=O)- karbonilcsoportot tartalmaz; ekkor formálisan ketonról van szó, és ketóznak nevezzük. A biológiai érdekű ketózisok általában a karbonil a 2. pozícióban van.
A fenti különböző osztályozások kombinálhatók, így például az “aldihexóz” és a “ketotrióz” elnevezéseket kapjuk.
A nyílt láncú monoszacharidok általánosabb nómenklatúrája a szénatomok számát jelző görög előtagot (tri-, tetr-, pent-, hex- stb.) kombinálja az aldózok esetében a “-óz” és a ketózok esetében a “-ulóz” utótagokkal. Az utóbbi esetben, ha a karbonil nem a 2. pozícióban van, akkor a pozícióját egy numerikus infix jelzi. Így például a H(C=O)(CHOH)4H pentóz, a H(CHOH)(C=O)(CHOH)3H pentulóz, a H(CHOH)2(C=O)(CHOH)2H pedig pent-3-ulóz.
Nyitott láncú sztereoizomerek
Két egyenértékű molekulagráffal rendelkező monoszacharid (azonos lánchossz és azonos karbonilhelyzet) mégis különböző sztereoizomerek lehetnek, amelyek molekulái térbeli orientációjukban különböznek. Ez csak akkor fordul elő, ha a molekula tartalmaz egy sztereogén centrumot, pontosabban egy szénatomot, amely királis (négy különböző molekuláris alstruktúrához kapcsolódik). Ez a négy kötés a térben két konfiguráció közül bármelyik lehet, amelyeket a kéztartásuk különböztet meg. Egy egyszerű, nyílt láncú monoszacharidban minden szénatom királis, kivéve a lánc első és utolsó atomját, valamint (ketózokban) a ketocsoportot tartalmazó szénatomot.
A triketóz H(CHOH)(C=O)(CHOH)H (glicerin, dihidroxiaceton) például nem rendelkezik sztereogén centrummal, ezért egyetlen sztereoizomerként létezik. A másik trióz, az aldóz H(C=O)(CHOH)2H (gliceraldehid) egy királis szénatomot tartalmaz – a központi, 2-es számú -, amely -H, -OH, -C(OH)H2 és -(C=O)H csoportokhoz kötődik. Ezért két sztereoizomerként létezik, amelyek molekulái egymás tükörképei (mint egy bal és egy jobb kesztyű). A négy vagy több szénatomos monoszacharidok több királis szénatomot is tartalmazhatnak, így jellemzően kettőnél több sztereoizomerrel rendelkeznek. Az azonos diagramú különböző sztereoizomerek számát 2c korlátozza, ahol c a királis szénatomok teljes száma.
A Fischer-vetület egy araciklikus monoszacharid vázképletének szisztematikus megrajzolása úgy, hogy az egyes királis szénatomok kéztartása jól meghatározott legyen. Egy egyszerű, nyílt láncú monoszacharid minden egyes sztereoizomerje azonosítható a királis hidroxilok (a királis szénatomokhoz kapcsolódó hidroxilok) Fischer-diagramban elfoglalt (jobb vagy bal oldali) helyzete alapján.
A legtöbb sztereoizomer maga is királis (különbözik a tükörképétől). A Fischer-vetületben két tükörkép izomer abban különbözik egymástól, hogy az összes királis hidroxil helyzete jobbra-balra felcserélődik. A tükörkép-izomerek kémiailag azonosak a nem királis környezetben, de általában nagyon eltérő biokémiai tulajdonságokkal rendelkeznek és a természetben is előfordulnak.
Míg a legtöbb sztereoizomer párban elrendezhető tükörképes formában, vannak olyan nem királis sztereoizomerek, amelyek a királis centrumok ellenére is azonosak tükörképeikkel. Ez akkor fordul elő, ha a molekulagráf szimmetrikus, mint a 3-ketopentózisok H(CHOH)2(CO)(CHOH)2H esetében, és a két fél egymás tükörképe. Ebben az esetben a tükrözés egyenértékű a félfordulatos forgással. Emiatt csak három különböző 3-ketopentóz sztereoizomer létezik, annak ellenére, hogy a molekulának két királis szénatomja van.
A nem egymás tükörképei, különböző sztereoizomerek általában eltérő kémiai tulajdonságokkal rendelkeznek, még nem királis környezetben is. Ezért minden tükörpár és minden nem királis sztereoizomer sajátos monoszacharid nevet kaphat. Például 16 különböző aldihexóz sztereoizomer létezik, de a “glükóz” név a tükörképes aldihexózok egy adott párját jelenti. A Fischer-vetületben a két glükóz-izomer közül az egyiknek a hidroxil a C3-on balra, a C4-en és a C5-en pedig jobbra van; míg a másik izomerben a minta fordított. Ezeknek a specifikus monoszacharidneveknek hagyományos hárombetűs rövidítései vannak, például “Glu” a glükózra és “Thr” a treózra.
Általában egy n aszimmetrikus szénatomszámú monoszacharidnak 2n sztereoizomere van. Egy aldóz-monoszacharid nyílt láncú sztereoizomereinek száma eggyel nagyobb, mint egy azonos hosszúságú ketóz-monoszacharidé. Minden ketóznak 2(n-3) sztereoizomerje lesz, ahol n > 2 a szénatomok száma. Minden aldóznak 2(n-2) sztereoizomerje van, ahol n > 2 a szénatomok száma. ezeket epimereknek is nevezik, amelyeknél az aszimmetrikus vagy királis szénatomoknál a -OH és -H csoportok eltérő elrendeződése figyelhető meg (ez nem vonatkozik azokra a szénatomokra, amelyeken a karbonil funkciós csoport van).
Monoszacharidok konfigurációja
Mint sok királis molekula, a gliceraldehid két sztereoizomerje is fokozatosan elforgatja a lineárisan polarizált fény polarizációs irányát, ahogy az áthalad rajta, még oldatban is. A két sztereoizomert a forgásiránynak megfelelően a D- és L- előtagokkal azonosítjuk: A D-gliceraldehid dextrorotációs (az óramutató járásával megegyező irányban forgatja a polarizációs tengelyt), míg az L-gliceraldehid levorotációs (az óramutató járásával ellentétesen forgatja).

A D- és L- előtagokat más monoszacharidoknál is használják, hogy megkülönböztessenek két adott sztereoizomert, amelyek egymás tükörképei. Ebből a célból a C=O csoporttól legtávolabb eső királis szénatomot tekintjük. Négy kötésének a -H, -OH, -C(OH)H és a molekula többi részéhez kell kapcsolódnia. Ha a molekula térben elforgatható úgy, hogy e négy csoport iránya megegyezik a D-gliceraldehid C2-csoportjának analóg csoportjaival, akkor az izomer megkapja a D- előtagot. Ellenkező esetben az L- előtagot kapja.
A Fischer-projekcióban a D- és az L- előtagok az alulról második szénatom konfigurációját adják meg: D-, ha a hidroxil a jobb oldalon van, és L-, ha a bal oldalon.
Megjegyezzük, hogy a D- és L- előtagok nem jelzik a polarizált fény forgási irányát, ami az összes királis centrum elrendeződésének együttes hatása. A két enantiomer azonban mindig ellentétes irányba, azonos mértékben forgatja a fényt. Lásd még D/L rendszer.
Monoszacharidok ciklizálása
A monoszacharid gyakran a karbonilcsoport és ugyanazon molekula egyik hidroxilcsoportja közötti nukleofil addíciós reakció révén vált át aciklikus (nyílt láncú) formából ciklikus formába. A reakció során egy szénatomokból álló gyűrű jön létre, amelyet egy áthidaló oxigénatom zár le. A keletkező molekula hemiacetál vagy hemiketál csoportot tartalmaz, attól függően, hogy a lineáris forma aldóz vagy ketóz volt. A reakció könnyen visszafordítható, így az eredeti, nyílt láncú formát kapjuk.
Egy ilyen ciklikus formában a gyűrű általában öt vagy hat atomból áll. Ezeket a formákat furanózoknak, illetve piranózoknak nevezik – a furán és a pirán, az azonos szén-oxigén gyűrűvel rendelkező legegyszerűbb vegyületek analógiájára (bár e két molekulából hiányzik a kettős kötés). Például az aldihexóz glükóz félacetális kötést képezhet az 1. szénatomon lévő hidroxil és a 4. szénatomon lévő oxigén között, így egy 5 tagú gyűrűvel rendelkező molekulát kapunk, amelyet glükofuranóznak nevezünk. Ugyanez a reakció lejátszódhat az 1. és az 5. szénatom között, és egy 6-tagú gyűrűvel rendelkező molekula, az úgynevezett glükopiranóz keletkezik. A hétatomos gyűrűvel rendelkező (az oxepánnal azonos), ritkán előforduló ciklikus formákat heptózoknak nevezzük.



Számos monoszacharidra (beleértve a glükózt is), szilárd állapotban és oldatokban is a ciklikus formák dominálnak, ezért általában ugyanazt a nevet használják a nyitott és zárt láncú izomerekre. Így például a “glükóz” kifejezés jelentheti a glükofuranózt, a glükopiranózt, a nyílt láncú formát vagy a három keverékét.
A ciklizáció új sztereogén centrumot hoz létre a karbonil-hordozó szénatomon. A karbonil oxigénjét helyettesítő -OH csoport a gyűrű középsíkjához képest két különböző pozícióba kerülhet. Így minden egyes nyílt láncú monoszacharid két ciklikus izomer (anomer) keletkezik, amelyeket az α- és β- előtagokkal jelölünk. A molekula e két forma között egy mutarotációnak nevezett folyamattal tud váltani, amely a gyűrűképző reakció megfordításából és az azt követő újabb gyűrűképződésből áll.
Haworth-projekció
A ciklikus monoszacharid sztereokémiai szerkezete Haworth-projekcióval ábrázolható. Ezen az ábrán a D-aldohexóz piranóz formájának α-izomerje esetében az anomer szén -OH-ja a szénatomok síkja alatt van, míg a β-izomer esetében az anomer szén -OH-ja a sík felett van. A piranózok jellemzően a ciklohexánhoz hasonló székkonformációt vesznek fel. Ebben a konformációban az α-izomerben az anomer szén -OH-ja axiális helyzetben van, míg a β-izomerben az anomer szén -OH-ja ekvatoriális helyzetben van (a D-aldohexóz cukrokat figyelembe véve).
-
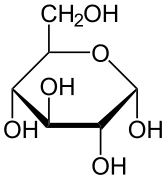
α-D-Glükopiranóz
-

β-D-Glükopiranóz
Származékok
Számos biológiailag fontos módosított monoszacharid létezik:
- Aminocukrok, mint például:
- galaktozamin
- glükozamin
- szialinsav
- N-acetilglükozamin
- Szulfoszugárok, mint például:
- Szulfokinovóz
- Más, mint például:
- aszkorbinsav
- mannit
- glükuronsav
Lásd még
- Monoszacharid nómenklatúra
- Redukáló cukor
- Cukorsav
- Cukoralkohol
- Diszacharid
.
Megjegyzések
- ^ “Szénhidrátok”. Kémia biológusok számára. Royal Society of Chemistry. Letöltve 2017. március 10-én.
- ^ NCERT TEXT BOOK CLaSS-12
- ^ “Carbohydrates”. Kémia biológusok számára. Royal Society of Chemistry. Retrieved 10 March 2017. március 10.
- ^ Pigman, William Ward; Anet, E. F. L. J. (1972). “Chapter 4: Mutarotations and Actions of Acids and Bases”. In Pigman és Horton (szerk.). A szénhidrátok: Chemistry and Biochemistry. 1A (2nd ed.). San Diego: Academic Press. pp. 165-194.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (az “Aranykönyv”) (1997). Online javított változat: (2006-) “Haworth reprezentáció”. doi:10.1351/goldbook.H02749


Vélemény, hozzászólás?