Mi a vas
A vas (ejtsd: EYE-ren) az átmeneti fémek családjába tartozó, nagy kereskedelmi értékkel bíró kemény fém. Fe kémiai szimbólummal jelölik, kémiailag reakcióképes, hajlamos a levegőn könnyen korrodálódni, és nedves levegőn rozsdának nevezett vöröses réteget képez .

Vas szimbólum
Hol található a vas
A negyedik leggyakoribb fém a földkéregben, általában más ásványi ércekkel, például hematittal, taconittal és magnetittal társul, amelyek Ukrajna, Brazília, Oroszország, Ausztrália és Kína bányászati készleteiben találhatók. Kereskedelmi előállítása kohóban történik az ércek kokszal és mészkővel történő hevítésével.
Története
Nevének eredete:
Ki fedezte fel: Ismeretlen
Mikor, hol és hogyan fedezték fel
Az egyiptomiak i. e. 3500 körül vélhetően már használtak vastárgyakat. A kis-ázsiai hettitákról ismert, hogy i. e. 1500 körül olvasztották ki a fémet érceiből. 1722-ben René Antoine Ferchault de Réaumur francia entomológus könyvet adott ki, amelyben leírta a különböző vasötvözetek jelentőségét .

Vasfém
Identifikáció |
|||
| Atomiaszám | 26 | ||
| CAS szám | 7439-89-.6 | ||
| Pozíció a periódusos rendszerben | Group | Period | Block |
| 8 | 4 | d | |
Hol van a vas a periódusos rendszerben
osztályozás, A vas tulajdonságai és jellemzői
Általános tulajdonságok |
||
| Relatív atomtömeg | 55.845 | |
| Atomi tömeg/tömeg | 55,845 atomi tömegegység | |
| Moláris tömeg/Molekulatömeg | 55.845 g/mol | |
| tömegszám | 56 | |
fizikai tulajdonságok |
||
| szín/fizikai megjelenés | ezüstszürke | |
| olvadáspont/fagyáspont | 1538°C (2800°F) | |
| forrpont | 2861°C (5182°F) | |
| sűrűség | 7.87 g/cm3 | |
| Standard/természetes állapot szobahőmérsékleten (szilárd/folyékony/gáz) | Szilárd | |
| Keménység | Igen | |
| Duktilitás | Igen | |
| Keménység | 4-5 Mohs | |
| Specifikus hőkapacitás | 0.444 J g-1 oC | |
| Hővezető képesség | 80.4 Wm-1K-1 | |
Kémiai tulajdonságok |
||
| Gyúlékonyság | nem gyúlékony | |
| Oxidációs állapotok (számok) | 6, 3, 2, 0,-2 | |
A vas (26. elem)
| Elektronkonfiguráció (nemesgázkonfiguráció) | 3d64s2 | ||||||
| Atomszerkezet | |||||||
| – Elektronok száma | 26 | ||||||
| – Neutronok száma | 30 | ||||||
| – száma Protonok száma | 26 | ||||||
| Atomsugár | |||||||
| – Atomsugár | 2.04 Å | ||||||
| – kovalens sugár | 1.24 Å | ||||||
| Ionizációs energia
(kJmol-1) |
1. | 2. | 3. | 4. | 5. | 6. | 7. |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
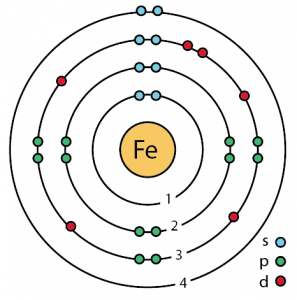
A vas atomszerkezete (Bohr-modell)
Milyen gyakori felhasználási területei vannak a vasnak
- A vasat más elemekkel, például szénnel ötvözve különböző típusú acélok előállítására használják, nikkel, króm és volfrám felhasználásával vágóeszközök, kerékpárláncok, puskacsövek, átviteli tornyok, hídgerendák és vasbeton gyártására.
- A vasat más fémekkel együtt nagy százalékban tartalmazó rozsdamentes acél hatalmas szilárdsággal és jobb működéssel rendelkezik, ami sebészeti műszerek, gemkapcsok, evőeszközök, golyóscsapágyak és ékszerek készítésénél hasznos .
- A Fe másik, olvasztással nyert kovácsoltvasnak nevezett formáját ácsszerszámok, emelőhorgok, láncok, kerítések és kapuk készítésére használják .
- A vastöltelékek alkalmazhatóak az elektromágnesesség tudományos kísérletekben a mágnesek erejének felmérésére, valamint az energetikai kohászatban, a művészeti alkotásokban, a tűzijátékokban és a homokfúvásban .
- A Fe hatékony katalizátorként működik néhány ipari kémiai folyamatban, mint például a Haber-folyamat és a Fischer-Tropsch .

Vasrúd
Az elemnek vannak mérgező hatásai
A Fe véletlenszerű lenyelése hányással, hasmenéssel és más gyomor-bélrendszeri problémákkal jár, ami a fémmérgezések gyakori típusa. A szervezetben való hosszan tartó felhalmozódás légzési problémákat és szívbetegségeket eredményezhet . A fémpor vagy füst belélegzése súlyos tüdőreakciót okozhat .
Érdekes tények
- A meteoritokról úgy tartják, hogy magas vastartalommal rendelkeznek .
- A vasat mágneses fémként használták az ókori navigátorok mágneskő formájában az iránytűk készítéséhez .
- Egy átlagos emberi szervezetben 4 gramm Fe van jelen, ami a hemoglobinhoz kapcsolódik, ami viszont segít az oxigén szállításában a tüdőbe .
-

Vaspor
Vasfém ára
A tiszta vas ára fontonként 0,24 és 0,30 dollár között változhat.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Vélemény, hozzászólás?