Keywords
CADASIL – stroke – MRI
Introduction
Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leucoencephalopathy (CADASIL) a kis artériák örökletes betegsége, amelyet a NOTCH-3 gén különböző patogenetikai mutációi okoznak. Jellemző rá az aurával járó migrén, a pszichiátriai tünetek, a korai életkorban visszatérő iszkémiás események és a kognitív károsodás társulása. Ez és a jellegzetes radiológiai leletek általában segítenek a betegség gyanújában. Általában a fiatal és középkorú felnőttek betegségének tartják, de az időseknél előforduló esetek aluldiagnosztizáltak lehetnek. Egy olyan férfi esetéről számolunk be, akinél a lánya korábbi diagnózisának köszönhetően a hetvenes évei végén CADASIL-t diagnosztizáltak.
Egyedi esetek
1. eset
Páciensünk lánya 50 éves volt, amikor a neurológiai ambulanciáról kórházunkba küldték további vizsgálatra, mert az agy MRI-vizsgálatának radiológiai leletei alapján mindkét külső kapszulában, a kétoldali periventrikuláris területeken és a bal halántéklebenyben fehérállomány-változásokat mutattak.
A fent említett klinikán azért jelentkezett, mert 30 éve szenvedett vizuális aurával járó migrénben, amelynek egyes epizódjai fejfájás nélküli vizuális aurára utaltak. Egyéb tünetei nem voltak. Foszfomicinre allergiás volt, és gyermekkorában mandulaműtéten esett át. Egyéb kórtörténete nem volt. Családi anamnézise figyelemre méltó volt: édesanyja migrénben és enyhe demenciában szenvedett, édesapja 75 éves korában agyvérzést kapott; apai nagyapja, nagybátyja és nagynénje agyvérzést kapott, és a nagybátyjánál Alzheimer-kórt diagnosztizáltak, egy apai unokatestvére máshol “ANA+ vasculitis” diagnózist kapott, egy másik apai unokatestvérnél pedig sclerosis multiplexet diagnosztizáltak. Két egészséges fia volt. A fizikális vizsgálat, beleértve az aprólékos neurológiai feltárást is, teljesen normális volt. Az agy ismételt MRI-vizsgálata többszörös hiperintenzív elváltozást mutatott a hátsó protuberancia fehérállományában, a periventrikuláris és szubkortikális területeken, beleértve az elülső temporális lebenyeket, különösen a bal oldalt, mindkét centrum semiovale-t, a belső és külső kapszulát, friss vagy korábbi mikrovérzésre utaló jelek nélkül (1. ábra). Az összes többi vizsgálat, beleértve a hemogramot, a glükémiát, a máj- és vesefunkciót, az eritrociták süllyedési sebességét, a szérum pajzsmirigyhormonokat, a hyperkoagulabilitás szűrését, a vasculitis szűrését, az EKG-t, a mellkasröntgent, a szifilisz- és HIV-szerológiát, valamint a supraaorta törzsek Dopplerrel végzett ultrahangvizsgálatát, normális volt, kivéve a 220 mg/dl-es koleszterinémiát, 152 mg/dl-es LDL-koleszterinnel. A bőrbiopszia szintén normális volt. A NOTCH 3 gén negyedik exonjában Arg169Cys mutációt (citozin-timin szubsztitúció az 505. kodonban) találtak, amelyről ismert, hogy patogenetikus, ezért CADASIL-t diagnosztizáltak nála. Ezzel a diagnózissal mindkét szülőt kivizsgálták klinikánkon.
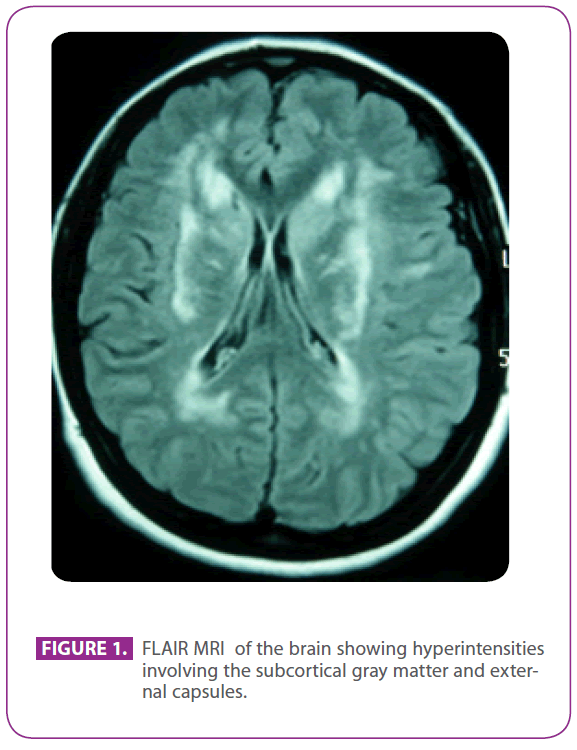
1. ábra: Az agy FLAIR MRI-je, amely a szubkortikális szürkeállományt és a külső kapszulákat érintő hiperintenzitásokat mutatja.
2. eset
Az édesanya 78 éves volt. Régóta előfordult nála aura nélküli migrén, és az utóbbi két évben enyhe demencia alakult ki nála szimmetrikus parkinsonizmussal, fluktuációval és REM alvási viselkedészavarral, ami Lewy-testes demenciára utalt. Az agyi MRI kizárta a releváns fehérállomány-betegséget.
Apa 79 éves férfi volt, számos érrendszeri kockázati tényezővel: 2-es típusú diabetes mellitus, dyslipidaemia és 50 éve dohányzott, 15 csomagév kumulált indexszel, bár 3 éve leszokott. Ischaemiás szívbetegsége volt, 1991-ben posteroinferior myocardialis infarktussal. Az elmúlt 8 évben három átmeneti iszkémiás balesete és egy lacunaris stroke-ja volt, amelyek különböző artériás területeknek feleltek meg, progresszív járáskárosodással, és az elmúlt 6 hónapban kissé visszahúzódóvá és apatikussá vált. A kórtörténetében nem szerepelt migrén. Metformint, clopidogrelt, atenololt és atorvastatint szedett. A fizikális vizsgálat során eszméleténél volt és tájékozódott, de kissé figyelmetlen volt, a nyelvi, távoli és friss emlékezet normális volt, ideomotoros apraxia, megváltozott hasonlóság- és szólásértelmezés, frontális felszabadulási reflexek nélkül. Globális hiperreflexiát is mutatott, kétoldali flexor plantar reflexekkel, valamint rövid lépésekkel és csökkent karmozgással járó járást. A két évvel korábban, az egyik átmeneti iszkémiás rohama után végzett CT-vizsgálat kiterjedt fehérállományi betegséget mutatott, különösen a külső kapszulában és a halántéklebenyben (2. ábra).
Összefoglalva, a betegnek visszatérő iszkémiás stroke-ja, enyhe szubkortikális kognitív károsodása és leukoencephalopathiája volt, ami erősen CADASIL-gyanús, figyelembe véve a lánya diagnózisát. Genetikai vizsgálatot végeztek, amely ugyanazt a NOTCH 3 mutációt mutatta ki, mint a lányáé, és megerősítette a diagnózist.
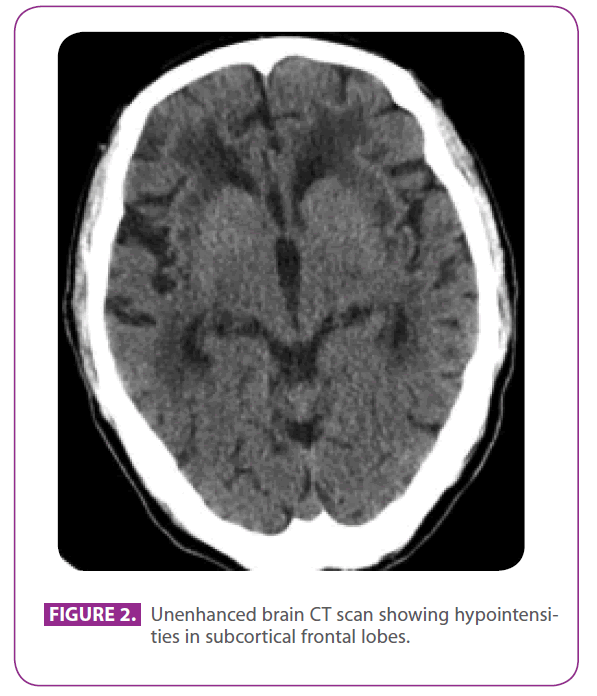
2. ábra: Unenhanced agyi CT-vizsgálat, amely hipointenzitást mutat a subcorticalis frontális lebenyekben.
Diszkusszió
A CADASIL a leggyakoribb örökletes kisérbetegség. Lehet azonban sporadikus is, mivel de novo mutációkat is leírtak. A NOTCH-3 gén különböző patogén mutációi okozzák, amely a 19. kromoszómán, a 19p13.2-p13.1 lókuszban található, és 33 exonból áll, amelyek egy 2321 aminosavból álló fehérjét kódolnak (1). Ez a fehérje egy szisztémás artériás simaizomsejtekben expresszálódó, egysejtes transzmembrán sejtfelszíni receptor, amely egy extracelluláris szabályozó doménnel és egy intracelluláris transzduktor doménnel rendelkezik. Eddig több mint 190 olyan mutációt jelentettek, amelyek CADASIL kialakulásához vezethetnek, és ezek mindegyike a NOTCH 3 gén 2-24. exonjában fordul elő, amelyek a NOTCH 3 extracelluláris részének 34 epidermális növekedési faktor-szerű ismétlődését kódolják. Ezért e 23 exon szűrése 100%-os érzékenységgel és közel azonos specificitással rendelkezik (2). E mutációk közül több mint 180 miszenzmutáció, legalább 6 deléció, egy inszerció, egy frameshift és 2 duplikáció. A legtöbb patogenetikus NOTCH3 mutáció a 3. és 4. exonban fordul elő (3).
Minden mutáció egy cisztein-maradék hozzáadását vagy elvesztését eredményezi egy EGF-szerű ismétlődésben, és így páratlan számú cisztein-maradékot, ami abnormális diszulfidhidak kialakulását eredményezi. A mutáns NOTCH3 a kis artériák és arteriolák érrendszeri sima sejtjeinek degenerációját és az abnormális fehérje felhalmozódását okozza ezen erek falában, ami lumenszűkülethez vezet (1). Az agyban a penetráló agyi és leptomeningeális artériákat érinti, ami ezen erek autoregulációs képtelenségét és az általuk öntözött területek hipoperfúzióját, és ezáltal infarktusokat okoz a fehérállományban.
A CADASIL első tünete, amikor megjelenik, általában az aurával járó migrén, átlagosan 30 éves korban kezdődik. A betegek 20-40%-ánál jelentkezik (4). A legtöbb roham tipikus, vizuális vagy szenzoros aurával, de a betegek felének atipikus rohama is van, baziláris, hemiplegikus vagy elhúzódó aurával.
A szubkortikális iszkémiás események, átmeneti rohamok vagy sztrókok a betegek 60-85%-ánál jelentkeznek, az első átlagosan 50 éves korban, bár már a második évtizedben is előfordulhat. Legtöbbször nincsenek hagyományos vaszkuláris rizikófaktorok, vagy azok nem túl jelentősek. A betegek kétharmadánál az iszkémiás események klinikailag és radiológiailag lacunaris szindrómaként jelentkeznek. A betegek többségénél több, általában 2-5 agyvérzés következik be, amelyek több év alatt járási nehézségekhez, vizelet- és székletinkontinenciához, demenciához és pseudobulbaris bénuláshoz vezetnek (1). A kognitív zavar a második leggyakoribb klinikai tünet. A legkorábbi jel általában a végrehajtó képességek és a feldolgozási sebesség károsodása, amely a legtöbb 35 évnél idősebb betegnél jelentkezik, de már az élet első évtizedében is megjelenhet (5). Ez a kognitív károsodás progresszív, és rendszerint súlyosbodik az ismétlődő stroke-ok során, kiegészülve az instrumentális tevékenységek, a memória, a nyelv, a gondolkodás és a vizuospatialis képességek károsodásával. A betegek több mint 70%-a demens lesz az élet hatodik évtizedére. Súlyos afázia, apraxia vagy agnózia ritkán fordul elő a CADASIL-ben.
Pszichiátriai zavarok, főként hangulatzavarok a betegek 20%-ánál jelentkeznek, általában súlyos depressziós epizódok formájában. Az apátia a betegek 40%-ánál fordul elő, és nem függ össze a depresszióval. Egyéb, ritkábban előforduló klinikai megnyilvánulások az akut reverzibilis encephalopathia (6) (a betegek 10%-ánál), amely legtöbbször aurás migrén után jelentkezik, görcsrohamok (a betegek 5-10%-ánál), süketség, parkinsonizmus, agyvérzés (főleg magas vérnyomásban szenvedő betegeknél) és szívinfarktus.
A CADASIL teljes penetrációja ellenére a CADASIL jelentős inter- és intrafamiliáris klinikai kifejeződési variabilitással rendelkezik. Ugyanaz a NOTCH-3 mutáció széles klinikai spektrumot mutat, a homozigóta és heterozigóta betegek között nincs egyértelmű különbség. Valójában nincs összefüggés a genotípus és a klinikai fenotípus között (4). Ezeknek a különbségeknek az oka nem ismert, de leírtak néhány lehetséges fenotípus-módosító tényezőt a CADASIL esetében, mint például a jelenlegi dohányzás a stroke kockázatát és az első stroke életkorát, a magas vérnyomás a stroke kockázatát, vagy a homociszteinszint a migrén megjelenésének életkorát (3,4). Ezek és más tényezők befolyásolhatják a betegség klinikai kifejeződését a génexpresszió módosításával vagy más fiziopatológiai útvonalak befolyásolásával, amelyek ugyanahhoz a klinikai manifesztációhoz vezethetnek.
A radiológiai változások minden CADASIL-mutációval rendelkező egyénnél megjelennek 35 éves kor előtt, és az idő előrehaladtával fokozódnak. A legkorábbi és leggyakoribb jellemzők az agyi fehérállomány és a szubkortikális struktúrák hiperintenzív, nem erősödő pontszerű területei az MRI T2-súlyozott és folyadékhígításos inverziós visszanyerési képeken. A külső kapszulák és a halántéklebenyek elülső részének érintettsége jellemző erre a betegségre, és támpontot ad a diagnózis felállításához, mivel segít a differenciáldiagnózisban más betegségekkel, például kisérbetegségekkel (1).
A CADASIL-t általában a fiatal és középkorú felnőttek betegségének tartják, de az idősebb betegek száma aluldiagnosztizált lehet (7,8). Második esetünk példaként szolgálhat: egy 79 éves, érrendszeri rizikófaktorokkal és visszatérő stroke-okkal rendelkező beteg, akinek fehérállomány-betegségét több neurológus is kisérbetegség szekunderének tartotta. A diagnózisra csak a leánykori mutációjának megismerése után jutottunk. Az egyértelmű családi anamnézis nélküli esetekben a nyitott szemlélet és a szuggesztív radiológiai leletekre, például a külső tok vagy az elülső temporális lebenyek érintettségére való gondos odafigyelés lehet az egyetlen támpont a helyes diagnózis felállításához.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: 11 beteg esetsorozata. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. A CADASIL klinikai spektruma és a kardiovaszkuláris rizikófaktorok hatása a fenotípusra: vizsgálat 200 egymást követően felvett egyénen. Stroke 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. A genetikai és kardiovaszkuláris kockázati tényezők hatása a CADASIL fenotípusára. Brain. 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepezil szubkortikális vaszkuláris kognitív károsodásban szenvedő betegeknél: randomizált kettős vak vizsgálat a CADASIL-ben. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. “CADASIL kóma”: aluldiagnosztizált akut enkefalopátia. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. NOTCH3-mutáció homozigozitása egy 65 éves, enyhe tünetekkel járó CADASIL-betegben: családi beszámoló. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. A CADASIL figyelemre méltóan változó expresszivitása: beszámoló egy magas életkorban minimális tüneteket mutató férfiról. J Neurol. 2009;256:1026-7
Vélemény, hozzászólás?