From Proteopedia
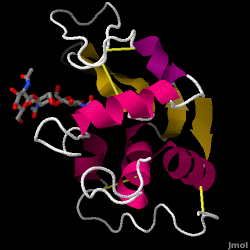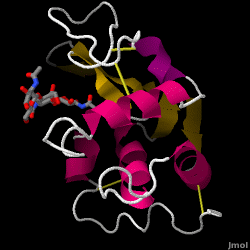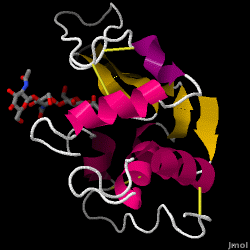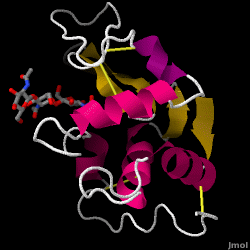
A lizozim – más néven muramidáz – egy erőteljes enzim, amely bőségesen megtalálható a könnyben, a nyálban és az emberi tejben. Emberben a LYZ gén kódolja. Mivel kis méretű, könnyen hozzáférhető és rendkívül stabil fehérjéről van szó, funkcióját és szerkezetét illetően kiterjedt kutatások tárgyát képezte.
Bevezetés
A lizozim nem specifikus védekezésként működik a baktériumok és gombák ellen. A veleszületett immunrendszer egyik összetevője, és a csecsemő étrendjének fontos része a hasmenés kivédésére. Ez egy olyan enzim, amely arról ismert, hogy képes lebontani sokféle sejtfal poliszacharid szerkezetét, általában a bakteriális fertőzés elleni védelem céljából. A cikk középpontjában álló tyúktojásfehérje (HEW) lizozim szerkezete a jobb oldalon látható. A tyúktojásfehérje antibakteriális aktivitását először Laschtschenko írta le 1909-ben. Alexander Fleming, akinek a penicillin felfedezését is tulajdonítják, jellemezte és nevezte el lizozimnak. Az enzimatikus aktivitás felfedezése véletlen volt; az egymástól független kísérlet során véletlenül orrcsepp került egy baktériumtenyészetet tartalmazó Petri-csészébe, amely kultúra ennek következtében egy eddig ismeretlen enzimatikus reakció eredményeit mutatta. Ennek az ismeretlen reakciónak a megfigyelése vezetett a reakció összetevőinek további kutatásához, valamint az újonnan felfedezett “lizozim” megfelelő azonosításához. 1965-ben David C. Phillips és munkatársai 2 Å felbontással meghatározták a lizozim háromdimenziós szerkezetét . Phillips munkája különösen úttörő volt, mivel Phillipsnek sikerült sikeresen felderítenie egy enzim szerkezetét röntgenkrisztallográfiával – ez a teljesítmény korábban még soha nem sikerült. Phillips kutatásai a hatásmechanizmus szerkezeten alapuló hipotéziséhez is vezettek.
Funkció
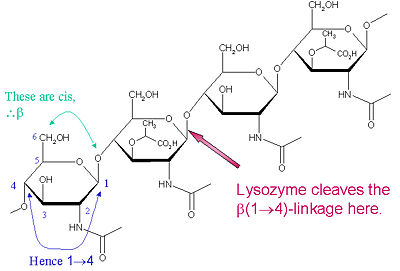
A hasítótípus sajátos szubsztrátja egy (NAG-NAM)₃ hexaszacharid, amelyen belül a szubsztrátban a hasító célglikozidos kötés, a NAM₄-β-O-NAG₅ fordul elő. Az egyes hexaszacharid kötőegységeket A-F jelölik, a NAM₄-β-O-NAG₅ glikozidos kötés hasítási preferencia megfelel a D-E egység glikozidos kötés cl
A lizozim ismert a bakteriális sejtfalak károsításáról az 1 hidrolízisének katalizálása révén,a peptidoglikánban lévő N-acetil-muraminsav (NAM) és N-acetil-D-glükózamin (NAG) maradékok, valamint a kitodextrinekben lévő N-acetil-D-glükózamin maradékok közötti 4-béta-kötések hidrolízisét. Ily módon a lizozim hatékonyan képes mind a baktériumok, mind a gombák sejtfalának lizálására. A lizozim számára a hasítás helye ebben az építészeti témában a β(1-4) glikozidos kötés, amely a NAM C1 szénatomját a NAG C4 szénatomjával köti össze.
A különleges szubsztrát, amelyet ez a hasítási típus előnyben részesít, egy (NAG-NAM)₃ hexaszacharid, amelyen belül a szubsztráton belül előfordul a hasító célglikozidos kötés, a NAM₄-β-O-NAG₅. Az egyes hexaszacharid-kötőegységeket A-F jelöli, a NAM₄-β-O-NAG₅ glikozidos kötés hasítási preferencia megfelel a D-E egység glikozidos kötés hasítási preferenciájának. Attól függően, hogy a lizozim milyen szervezetből származik, a glikozidos kötés hidrolízise az anomer szénatomon a konfiguráció megtartásával (tyúktojásfehérje) vagy inverzióval (liba, T4-fág) történik.
A lizozim hatékonyan hat hosszú (NAG-NAM) vagy (NAG) polimerekre. Ahogy a lánc hossza hat monomernél kisebb lesz, a katalitikus sebesség jelentősen csökken; valójában a triszacharidok kompetitív inhibitorokként viselkednek, mivel nem produktív regiszterben kötődnek az aktív helyhez.
Hen tojásfehérje lizozim (PDB kód 1hew)
Mechanizmus
A glikozidos kötések hidrolízise a tyúktojásfehérje lizozim által a konfiguráció megtartásával zajlik. 1953-ban Koshland felvetette, hogy általában a konfiguráció megtartása kettős elmozdulásos mechanizmust feltételez (míg a konfiguráció inverziója egyszerű elmozdulást jelent). Évtizedekig két versengő mechanisztikus hipotézist (Phillips: disszociatív mechanizmus oxokarbénium intermedierrel; Koshland: kétlépéses asszociatív mechanizmus kovalens enzimkomplexszel mint intermedierrel) tartottak számon, és a 2001-es adatok egy kovalens intermedier létezése felé billentették a mérleg nyelvét. A szubsztrátkomplex szerkezetének hiánya minden bizonnyal hozzájárult a lehetséges mechanizmusok közötti különbségtétel nehézségeihez, csakúgy, mint az enzimek ugyanazon szerkezeti családján belül két különböző mechanizmus (a konfiguráció megtartása és inverziója) létezése (pl. tyúk vs. liba enzim).
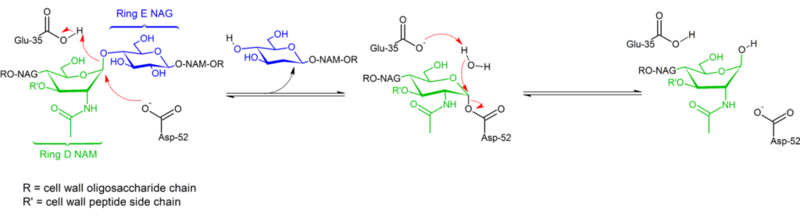
A lizozim egy glikozidot hidrolizál (ezért a lizozim családi besorolása glikoziláz), ami megfelel egy acetál félacetálná történő átalakításának. A reakció két lépésben megy végbe a fenti ábrán látható módon. Az első lépésben az Asp 52 nukleofilként viselkedik, és a cukor egy része a távozó csoport. A második lépésben a víz nukleofilként, az Asp 52 pedig távozó csoportként viselkedik. Mindkét lépés megfordítja a konfigurációt az anomer szénatomon, ami a konfiguráció általános megtartásához vezet. A Glu 35 az első lépésben savként viselkedik (protonálja a cukrot a glikozidos kötésben, hogy jobb elektrofil legyen), a második lépésben pedig bázisként (deprotonálja a vizet, hogy jobb nukleofil legyen). Bár az ábra a konfiguráció inverziójának hangsúlyozása érdekében néhány cukrot csónakkonformációban mutat, ezek kísérletileg nem figyelhetők meg, hanem inkább székkonformációban találhatók.
A lizozim alkalmazásai
Mióta a lizozim széles körben ismert antibakteriális és gombaölő tulajdonságai miatt, a biokémiai és gyógyszerészeti alkalmazásokban is sokféleképpen használják. A molekuláris biológiában a lizozimot gyakran használják a plazmid DNS kivonására és izolálására szolgáló lúgos-liázos eljárásban. A gyógyszeriparban széles körben használják a gram-pozitív baktériumok elpusztítására, és felhasználható a már meglévő immunvédekezés támogatására a bakteriális fertőzések elleni küzdelemben. Ez az enzim különösen fontos a csecsemők bakteriális betegségeinek megelőzésében. Antibakteriális tulajdonságai miatt a lizozim az élelmiszeriparban is felhasználható az élelmiszerek romlásának megelőzésére.
Lásd még
- Lysozyme 3D struktúrák
- Lysozyme
- Retaining Glycoside Hydrolases
- Molecular Playground/Lysozyme
- User:Judy Voet/Lysozyme
- Lysozyme (arab)
- Lysozyme (héber)
- Ragland SA, Criss AK. A baktériumöléstől az immunmodulációig: A lizozim funkcióinak legújabb meglátásai. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming,A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. A tyúktojásfehérje lizozim szerkezete. Háromdimenziós Fourier-szintézis 2 Angström felbontással. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. Bevezetés az enzimek és koenzimek kémiájába. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. A tyúktojásfehérje lizozim aktivitásának kristallográfiai vizsgálatai. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Image from: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. A fehérjék korai szalagrajzai. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. A tyúktojásfehérje lizozim szerkezete. Háromdimenziós Fourier-szintézis 2 Angström felbontással. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Néhány kristályos lizozim-inhibitor komplex szerkezetének meghatározása 6 Angström felbontású röntgenanalízissel. Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. A tyúktojásfehérje lizozim által végzett katalízis egy kovalens köztiterméken keresztül megy végbe. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers és Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia oldal Hozzászólók és szerkesztők (mi ez?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
-ről lekérdezve.
Vélemény, hozzászólás?