- Introduction
- Kísérleti
- Anyagok
- Interkalációs vegyületek szintézise
- Karakterizálás
- Eredmények és megbeszélés
- XRD jellemzés
- FTIR spektrum
- A Kaol/alkilamin interkalációs vegyületek szerkezeti modellje
- Thermikus analízis
- Bomlási reakciókinetika
- Következtetések
- Author Contributions
- Interdekütközésre vonatkozó nyilatkozat
- Köszönet
Introduction
Az agyag/polimer nanokompozitok tervezése és előállítása nagy érdeklődést váltott ki mind a tudományos, mind a mérnöki közösségekben (Cheng et al., 2017). Az agyag/polimer nanokompozitok széles skáláját fejlesztették ki, és széles körben alkalmazzák őket (Gogoi és Raidongia, 2017). Az agyagok előinterkalálása, majd a polimerek beépítése az agyagásványok rétegébe széles körben elfogadott megközelítés az agyag/polimer nanokompozitok előállítására (Li et al., 2009; Zare et al., 2017). A szervetlen agyagrétegekbe való interkaláció során a szerves polimerláncok természetesen csökkentik szerkezeti mobilitásukat, és némelyikük a réteges szerkezeten belül erősen szervezett konformációt vesz fel.
A természetben a kaolinit (Kaol) egy olyan típusú agyagásvány, amelynek 1:1 dioktaéderes alumínium-szilikát réteges szerkezete van (Brindley és Robinson, 1945). A Kaol rétegeit hidrogénkötések, dipól-dipól kölcsönhatások és van der Waals-erők tartják össze (Brindley et al., 1967). A Kaol galériájába azonban csak korlátozott számú erősen poláros szerves anyagot, köztük karbamidot (Makó és mtsai., 2009), dimetil-szulfoxidot (Costanzo és Giesse, 1986), formamidot (Frost és mtsai., 2000a), hidrazin (Cruz és Franco, 2000) és kálium-acetátot (Frost és mtsai., 2000b) sikerült interkalálni. A kismolekulák Kaol rétegekbe történő interkalációja a bazális távolság növekedését okozza, és előzetes expanziós lépésként használható a nagy méretű, nem reaktív fajok későbbi beillesztéséhez az előzetesen interkalált kismolekulák kiszorításával (Cheng et al., 2015). A korábbi beszámolók alapján például a Kaol/methanol interkalációs vegyület hatékony intermedier lehet etilénglikollal (Hirsemann et al., 2011), hexilaminnal (Matusik et al., 2012), n-alkilaminokkal (Gardolinski és Lagaly, 2005) és kvaterner ammóniumsókkal (Cheng et al., 2016) történő további interkalációs reakcióhoz. Emellett a vendégmolekulák többsége nehezen illeszthető be a rétegek közötti térbe, ennek egyik oka az erős hidrogénkötések, a másik pedig az, hogy a Kaol szerkezetben nincsenek cserélhető ionok.
Noha az agyag/polimer nanokompozitokat az elmúlt években jól kidolgozták, az új agyag/szerves nanokompozitok szintézise a potenciális alkalmazás érdekében még mindig nagy kihívást jelent (Kotal és Bhowmick, 2015). A probléma megoldása érdekében valóban sürgős feladat a kaolinit interkaláció nanoméretű folyamatának kiderítése és a bomlási mechanizmus alapos vizsgálata modern technológiával és analitikai eszközökkel. Az agyag/polimer interkalációs vegyületek termikus elemzése és kinetikai számítása segíthet a bomlási folyamatok jellemzésében, és tudományos alapot biztosíthat az interkalációs reakciók ellenőrzéséhez (Zhang et al., 2015). A bomlási reakció kinetikai folyamatának kinetikai paramétereit, mint például az aktiválási energia, a preexponenciális, a reakciórendek és a sebességállandó, az agyag/polimer termogramok adatai alapján értékeltük. Ebben a tanulmányban a Kaol interkalációját vizsgálták különböző alkilaminokkal. Emellett szisztematikusan vizsgálták az interkalációs folyamatot és a bomlási mechanizmust.
Kísérleti
Anyagok
A jelen tanulmányban használt kaolint a kínai Zhangjiakou városból hasznosították. A fő ásványi összetétel egy jól rendezett kaolinit (95% tömegben). Az interkalálás előtt úgy őrölték, hogy átmenjen egy 325 szemű szitán (< 44 μm méretű részecskék). Az alkilamin-hexilamint (HA, 99%), dodecilamint (DA, kémiailag tiszta) és oktadecilamint (OA, kémiailag tiszta) a Nanjing Shuguang Chemical Company-tól (Kína) vásároltuk. A dimetil-szulfoxidot (DMSO, analitikai reagens), a metanolt (MeOH, analitikai reagens) és a toluol (99%) a Xilong Chemical Company-tól (Kína) kaptuk, és további tisztítás nélkül, a kapott formában használtuk fel. A HA, DA és OA kémiai képlete és szerkezeti képlete az 1. táblázatban látható.

Az 1. táblázat. A HA, DA és OA kémiai és szerkezeti képlete.
Interkalációs vegyületek szintézise
Először a Kaol/DMSO interkalációs vegyületet úgy állítottuk elő, hogy 20,0 g Kaolt 36,0 g DMSO és 4,0 g víz keverékébe diszpergáltunk. Az elegyet vízfürdőben 2 órán át kevertettük 95°C-on, majd a szuszpenziót etanolos centrifugálással elválasztottuk. Másodszor, a Kaol/DMSO interkalációs vegyületet prekurzorként használtuk a további reakcióhoz MeOH-val. MeOH-t adtunk az előinterkalált Kaolhoz, és a reakcióelegyet 10 napig kevertettük, a MeOH-t minden nap azonos mennyiségű friss MeOH-val cseréltük. Az elegyben lévő csapadékot centrifugálással elválasztottuk, és 60 °C-os kemencében 12 órán keresztül szárítottuk, hogy Kaol/MeOH interkalációs vegyületeket kapjunk. Végül 2 g Kaol/MeOH interkalációs vegyületet 30,0 mL HA, DA, illetve OA metanolos oldattal (1 mol/l) keverve, szobahőmérsékleten kevertettük. A diszperziókat a reakciót követően 24 órán keresztül centrifugáltuk. Az üledéket háromszor mostuk toluolnal a felesleges HA, DA vagy OA eltávolítása érdekében. A mintákat szobahőmérsékleten 12 órán keresztül szárítottuk, majd achátmozsárral porrá őröltük (Komori et al., 1999). Az így kapott vegyületeket Kaolpi/HA (pi mint előinterkalált), Kaolpi/DA és Kaolpi/OA néven jelöltük.
Karakterizálás
A XRD mintákat Rigaku D/max 2500PC röntgendiffraktométeren rögzítettük Cu Kα (λ = 1,54178 Å) sugárzással 40 kV és 150 mA mellett működő Cu Kα (λ = 1,54178 Å) sugárzással. A véletlenszerűen orientált minták mintáit az 1 és 20° közötti 2θ tartományban 2° min-1 sebességgel pásztáztuk. A Thermo Fisher Nicolet 6700 spektrofotométert használtuk az FTIR spektrumok felvételéhez a 4000~400 cm-1 tartományban. A TG-DSC elemzéseket egy Mettler-Toledo TG-DSC I/1600 HT szimultán termikus analizátorral végeztük nitrogén atmoszférában. Húsz milligramm mintát alumínium-oxid tégelybe helyeztünk, és 30 °C-tól 1100 °C-ig melegítettük 4, 6, 8, 10 °C min-1 fűtési sebességgel.
Eredmények és megbeszélés
XRD jellemzés
A pristin Kaol és az interkalációs vegyületek XRD mintázatát az 1. ábra mutatja. Az érintetlen Kaol mintázata jól rendezett réteges szerkezetet mutat, 0,71 nm bazális távolsággal. Ez az érték jól illeszkedik a 14-0164 szabványos ICDD referenciamintázathoz. A DMSO-val történő kezelés után egy új bazális reflexiós csúcs jelent meg 1,14 nm-nél, ami azt jelzi, hogy a DMSO-t sikeresen beillesztették a Kaol rétegek közé. Miután a Kaol/DMSO interkalációs vegyületet MeOH-val kezelték, a Kaol/DMSO interkalációs vegyület 1,14 nm-es (001) reflexiós jellemzője 0,86 nm-re tolódott el. Matusik és munkatársai (2012) arról számoltak be, hogy a Kaol/DMSO/MeOH vegyületet 110 °C-on szárították, a d = 1,12 nm-es reflexió eltűnt, és egy széles, 0,95 nm-es maximummal rendelkező reflexiót figyeltek meg. A CHNS analízis alapján kiszámított Kaol/DMSO interkalációs vegyület Al2Si2O5(OH)3,20(OCH3)0,80 kémiai képlete alapján azt mutatta, hogy a belső felületi OH csoportok kb. 1/3-át metoxicsoportok helyettesítették, és ez a megfigyelés is Kaol/MeOH interkalációs vegyület kialakulására utal (Tunney és Detellier, 1996; Cheng et al., 2015). Az XRD minták azt is mutatják, hogy a HA-val, DA-val és OA-val interkalálódott Kaol/MeOH vegyületek a c tengely mentén bővítik a szerkezetet, ami nagy, 2,86, 4,08 és 5,66 nm-es rétegközi távolságot eredményez. A HA, DA és OA molekulaláncok hossza 1,56, 2,51 és 3,65 nm (McNulty et al., 2011, 2014). Összességében a Kaol/alkilamin interkalációs vegyületek rétegközi távolsága az alkilaminok alkilláncainak hosszával nőtt, de az alkilamin molekula nem egyrétegű vagy kétrétegű szerkezetű, amely merőleges a Kaol felületére.
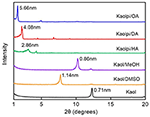
1. ábra. A Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA és Kaolpi/OA XRD mintái.
FTIR spektrum
AFTIR spektroszkópiát széles körben használják az interkalációs vegyületek jellemzésére (Ledoux és White, 1964; Frost et al., 2000c; Cheng et al., 2012). Az eredeti Kaol, a Kaolpi/HA, a Kaolpi/DA és a Kaolpi/OA interkalációs vegyületek FTIR spektrumát a 2. ábra mutatja. A 432, 470 és 541 cm-1-es jellegzetes sávok (2B. ábra) a Si-O, Si-O-Si és Al-O-Si deformációs módjához tartoznak. Az 1 009, 1 031 és 1 114 cm-1 (2C ábra) sávok a Kaol rétegben a Si-O-Si nyújtási rezgéseihez tartoznak. A Kaol és az interkalációs vegyületek spektrumát összehasonlítva a sávok helyzete nem mutat nyilvánvaló eltérést, ami arra utal, hogy ezeket a nyújtórezgés-sávokat nem befolyásolják az interkalált molekulák.
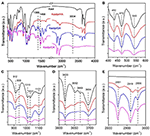
2. ábra. A Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA infravörös spektrumai.
A 912 és 938 cm-1 -nél lévő sávok (2C ábra) a belső hidroxilcsoportok OH-deformációjához és a belső felületi hidroxilcsoportokhoz tartoznak. Az eredeti Kaol spektrumában négy nyilvánvaló hidroxilnyújtó sáv található 3,694, 3,669, 3,652 és 3,620 cm-1 (2D ábra), a 3,694, 3,669 és 3,652 cm-1 sávokat a belső-felszíni hidroxilcsoportok, míg a 3,620 cm-1 sávot a belső hidroxilcsoportok okozzák (Farmer, 1964; Ledoux és White, 1964; Giese és Datta, 1973). Az alkil-amin molekulák interkalációja után néhány sáv meggyengült a szomszédos atomokkal való kölcsönhatások megváltozása miatt. A 3,697 cm-1-re történő eltolódás és a 3,694 cm-1-nél lévő sáv intenzitásának csökkenése arra utal, hogy a Kaolban számos hidroxilcsoport vett részt és hidrogénkötést alakított ki az alkil-amin molekulák amincsoportjaival (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
A rétegközi alkil-amin molekulák jelenlétét az FTIR spektrumon új csúcsok mutatták ki, amelyeket a 2A,E ábrák mutatnak. Az interkalációs vegyületek esetében néhány nyilvánvalóan jellegzetes csúcs, például az 1388 és 1468 cm-1 -nél lévő sáv a -CH3 és a -CH2 C-H hajlítási módjához tartozik. Egy új rezgési sávot figyeltünk meg 3,334 cm-1 -nél, amely az N-H nyújtási rezgés nyújtási módusának köszönhető (Griffiths és De Haseth, 2007; Zhang és mtsai., 2018). Új rezgési sávot figyeltünk meg 2,956 cm-1-nél, amelyet általában a terminális metilcsoportok C-H aszimmetrikus nyújtási sávjához rendelnek (Cheng et al., 2016). A 2,919 és 2,851 cm-1 -nél lévő két rezgési sávot általában a -(CH2)n- szimmetrikus és aszimmetrikus nyúlási rezgéséhez rendelik (Venkataraman és Vasudevan, 2001). A sávok intenzitása fokozatosan növekszik, ami azt jelenti, hogy több alkilamin-szénatom került be a Kaol-rétegekbe. Továbbá az alkilaminok illékonysága a szénlánc növekedésével csökken, így a megfelelő Kaol interkalációs vegyületek stabilitása fokozatosan nő a nagyobb alkilamin molekulatömeggel (Wang és mtsai., 2010).
A Kaol/alkilamin interkalációs vegyületek szerkezeti modellje
A Kaol/alkilamin interkalációs vegyületek szerkezetének kísérleti elemzésének alapja az interkalált molekulák elrendezése. Lagaly (1981) szerint a montmorillonit-kvaterner ammóniumsó interkalációs vegyületek szerkezeti modelljei három kategóriába sorolhatók: (a) monorétegek: rövid láncú alkilamin-ionok; b) kétrétegek: hosszú láncú kvaterner ammónium-ionok; c) háromrétegek: nagy töltésű agyagásványokban lévő görbült alkil-láncok. Beneke és Lagaly (1982) az XRD alapján tovább javasolták az interkalált alkil-amin molekulák különböző szerkezetét, amelyeket a következőkben foglalnak össze: (a) a rétegek közötti térben az alkiláncok a (001) kristálysík felé dőlnek; b) az alkiláncok kétrétegben helyezkednek el. Brindley és Moll (1965) leírta, hogy az interkalált molekulák egy rétegben a szilikátlapokhoz dőlnek, míg a (001) kristálysíkhoz képest kb. 65°-os szöget zárnak be. Ha a kölcsönhatásba lépő molekulák az aktív hidroxilcsoportok révén egységesen kapcsolódnak minden szilikátfelülethez, akkor egy “végtől végig” páros szerveződésre utalnak, némi hosszirányú elmozdulással. A dőlésszög összhangban van a szilikát oxigénfelületek és a terminális hidroxilcsoportok közötti lehetséges szoros pakolási móddal és a láncmolekulák egymás közötti szoros pakolásának mértékével.
Az alkilmolekulák nehezen interkalálódnak közvetlenül az eredeti Kaol rétegekbe, mivel a Kaol rétegközi terében nincsenek cserélhető ionok. Az érvényes prekurzorok nélkülözhetetlenek, amikor az alkil-amin molekulák beilleszkednek a Kaol rétegközi rétegébe. Arról számoltak be, hogy az alkil-trimetil-ammónium-klorid lánc ferde kétrétegű réteget képez a Kaol interrétegében, és a ferde szög a számítás után ~36° (Kuroda et al., 2011). Yuan és munkatársai (2013) rámutattak, hogy a kvaterner ammónium-só molekulák szerkezeti elrendeződése a Kaol köztes rétegében döntött kétrétegű, és a dőlésszög ~38,4°. Gardolinski és Lagaly (2005) azt javasolta, hogy az alkil láncok a köztes rétegekben teljesen megnyúltak és a Kaol felületére merőlegesen orientáltak a kétréteg által. Ezért a HA, DA és OA molekulaláncok hosszának elemzéséből az a következtetés vonható le, hogy az interkalációt követő bazális távolság nem elegendő ahhoz, hogy az alkiláncok függőlegesen és kétrétegszerűen lépjenek be. Az XRD eredmények további elemzésével látható, hogy a HA, DA és OA alkiláncai a kétrétegben a Kaol felület felé dőlnek, és az alkiláncok dőlésszöge kb. 39,9, 39,9, 41,1°. Ezenkívül a Kaol belső felületén lévő hidroxil és az alkil-amin molekulák amincsoportjai közötti hidroxilkötés miatt a Kaol/alkil-amin interkalációs vegyületek legvalószínűbb szerkezeti modellje a 3. ábrán látható.
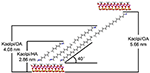
3. ábra. A kaolinit/alkilamin interkalációs vegyületek legvalószínűbb szerkezeti modellje.
Thermikus analízis
A Kaol és interkalációs vegyületeinek TG-DSC analízis eredményei a 4. ábrán láthatóak. A Kaol fő tömegvesztesége 400 és 600°C között jelentkezik, a maximális veszteség mértéke 525°C-on a kristályrács dehidroxilációja miatt bekövetkező vízveszteségnek tulajdonítható, ami meta-kaolinit képződését eredményezi (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Ez a veszteség a teljes tömeg mintegy 12,7%-ának felel meg, ami rendkívül közel van az elméleti referenciaértékhez (13,9%). Az eredeti Kaol TG-DSC görbéinek összehasonlításával a Kaolpi/HA, Kaolpi/DA és Kaolpi/OA interkalációs vegyületeknél két fő tömegvesztési lépcső figyelhető meg. Az első 150 és 350°C között következett be, ami az interkalált alkil-amin molekulák bomlásának köszönhető (Yuan et al., 2013). A második körülbelül 500°C-on következett be, ami a dezinterkalált Kaol dehidroxilációjának köszönhető. A Kaolpi/OA esetében néhány OA interkalálódott a szilikátrétegek közötti térbe, hogy stabil interkalációt képezzen, ami XRD-mintával bizonyítható. Néhány molekula egymásba gabalyodott a hosszú lánc vagy a nanotekercsekben lévő szorítás miatt, amelyet nem lehet teljesen eltávolítani (Li és mtsai., 2015; Liu és mtsai., 2016). 220°C-on a markáns tömegveszteség a bevont vagy nem kötött OA bomlásának köszönhető, míg a 330°C-on bekövetkező tömegveszteség az interkalált OA bomlásának tulajdonítható. A 996°C-os exoterm csúcs a Kaol átkristályosodásából ered.
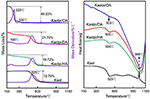
4. ábra. A Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA TG-DSC görbéi.
Az eredeti Kaol és a Kaol/alkilamin interkalációs vegyületek (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA) TG-DSC görbéinek összehasonlításával megfigyelhető: (a) különböző tömegvesztési lépések, valamint jelentős különbség van a Kaolpi/OA és a másik két interkalációs vegyület (Kaolpi/HA, Kaolpi/DA) közötti tömegveszteségben. A Kaolpi/HA és a Kaolpi/DA bomlásának tömegvesztesége kb. 20% volt, de a Kaolpi/OA esetében a két tömegveszteség összege kb. 50%. Ez annak tudható be, hogy nagyobb mennyiségű OA interkalálódott a szilikátrétegek közötti térbe, mint a HA és DA (Wang et al., 2017). (b) Az interkalációs vegyületek dehidroxilációs hőmérséklete körülbelül 20°C-kal alacsonyabb volt, mint az eredeti Kaolé. Ennek oka, hogy az interkalációs molekulák kitágították a rétegközi teret, gyengítették a Kaol rétegek közötti hidrogénkötéseket, ami könnyebb dehidroxilációt eredményezett a Kaol felületéről. Ezért a Kaol kristályossága meredeken csökkent az interkaláció után, amit az XRD és az IR (800 cm-1 alatt) is megerősít. Ez az eredmény összhangban van néhány más jelentés következtetésével, miszerint a dehidroxiláció hőmérsékletét a Kaol kristályossága határozza meg (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Bomlási reakciókinetika
A Kaol/alkilamin interkalációs vegyület bomlási kinetikáját termogravimetriás technikával vizsgáltuk. A bomlási folyamat kinetikai paramétereit (aktiválási energia E és a preexponenciális tényező A) KAS és Ozawa módszerek (Kissinger, 1957; Škvára és Šesták, 1975) alapján számoltuk ki. A kaol/alkilamin interkalációs vegyület termikus lebomlási mechanizmusát Satava integrál módszerrel vizsgáltuk (Xie et al., 2001; Gao et al., 2005; Zhang et al., 2015).
A reakcióelmélet szerint a nem izotermikus bomlási kinetikai képletet általában a következőképpen fejezik ki:
ahol α a B(s) konverziós sebességének mértéke t időpontban, f (α) a reakciómechanizmus függvénye, k pedig a reakciósebességi állandó. A k a következő egyenletnek engedelmeskedik:
Ha a minta hőmérsékletét állandó fűtési sebességgel szabályozzuk (β = dT/dt), a reakciósebesség a következőképpen határozható meg:
A változó szétválasztása után a (4) egyenlet integrál- vagy differenciálfüggvényekkel való átrendezésével a KAS (5) egyenlet és az Ozawa (6) egyenlet a következőképpen számítható:
Ahol G(α) az átalakítás integrálfüggvényét jelenti. Az integrál közelítés miatt az E kiszámításához iteratív módszereket alkalmaztunk bizonyos eltérések elkerülése érdekében. Az iteratív módszerek függvényei a következők:
Tegyük fel x = E/RT, h(x) és H(x) definíciója:
Az iteráció a következő három lépésből áll:
(a) Állítsuk be h(x) = 1 vagy H(x) = 1, számítsuk ki E0-t a legkisebb négyzetek módszerével a lnβ/T2 és lnβ lineáris kapcsolat meredeksége alapján 1/T-re.
(c) Helyettesítsük E0-t E1-re, ismételjük meg a (b) lépést, amíg Ei-Ei-1 < 0. 1 kJ mol-1. Ei a bomlási reakció aktiválási energiájának pontos értéke.
A Kaol/alkilamin interkalációs vegyületek E értékeit KAS, Ozawa és iteratív módszerekkel számoltuk ki (2. táblázat). A KAS módszerrel kapott számított eredmények közelebb álltak az iteratív módszerek eredményeihez, azonban az Ozawa iteratív módszerrel kapott eredmények nagyobb eltérést mutattak a többihez képest. Ezért az iteratív módszerekből származó átlagos E-t tekinthetjük a bomlási reakció aktiválási energiájának, mivel ezek a KAS és Ozawa módszerekhez képest javulást jelentenek. A Kaolpi/HA, Kaolpi/DA és Kaolpi/OA átlagos E értéke 104,44, 130,80 és 154,59 kJ mol-1. Látható, hogy a Kaol/alkilamin vegyületek között az átlagos E pozitív korrelációt mutat az alkillánc hosszával. Ennek egyik oka, hogy az illékonyság az alkillánc növekedésével gyengül. A másik ok az, hogy a Kaolpi/OA rendelkezik a legjobban rendezett interkalációs szerkezettel, amelyből a legnehezebb a deinterkaláció. Ezeket az eredményeket pedig az XRD-minták is megerősítik.
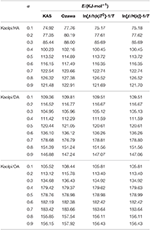
Táblázat 2. táblázat. KAS, Ozawa és iterációs módszerekkel számított, különböző α értékű kaol/alkilamin interkalációs vegyületek E értékei.
A bomlási reakciómechanizmus függvényeit és A értékeit Satava módszerekkel számoltam, melyeket a következőképpen írtam le:
Az α-t minden G(α) mechanizmusfüggvénybe behelyettesítve megkapjuk az lg értékét, az lg lineáris illesztését és a fűtési sebességnek megfelelő 1/T értékét, a legnagyobb illesztéssel rendelkező függvényt lehet a legvalószínűbb mechanizmusfüggvényként meghatározni. Az E és A értékeit pedig a lineáris illesztési görbe meredekségén és metszéspontján keresztül kaphatjuk meg.
Amint a 3. táblázatban látható, a Satava integrálképlet alapján öt olyan mechanizmusfüggvényt választunk ki, amelyek illeszkedési jósága 90% feletti. Az öt függvény összehasonlításával a 9. számú G(α) = 2 mechanizmusfüggvény, amelynek illeszkedési jósága 97% körüli, tekinthető a legvalószínűbb mechanizmusfüggvénynek, és a 9. számú függvény lineáris illesztési görbéje az 5. ábrán látható. E és A szintén a bomlási kinetika normál tartományában van. A három kaol/alkilamin interkalációs vegyület bomlási mechanizmusfüggvényeit a 4. táblázat tartalmazza.

3. táblázat. A Satava integrál módszerrel megítélt kiválasztott kinetikai mechanizmusfüggvények.

5. ábra. A 9. számú függvény lineáris illesztési görbéi a Satava integrál módszerrel megítélve.

A 4. táblázat. A kaol/alkilamin interkalációs vegyületek kinetikai mechanizmusfüggvényei.
Következtetések
A kaol/alkilamin interkalációs vegyületek lehetséges szerkezeti modelljeit és bomlási kinetikáját XRD, FT-IR és TG-DSC segítségével vizsgáltuk. A Kaol/MeOH vegyület interkalációja HA-val, DA-val és OA-val kitágítja a Kaol rétegközi távolságát a c tengely mentén, ami a 2,86, 4,08 és 5,66 nm-nél megjelenő domináns reflexiót eredményezi. Ezenkívül az interkalációt követő bazális távolság nem elegendő ahhoz, hogy az alkilánc függőleges egy- és kétrétegű módon lépjen be. Arra a következtetésre jutottunk, hogy a HA, DA és OA alkiláncai a kétrétegben a Kaol felületéhez dőlnek, és az alkiláncok dőlésszöge ~40°.
A KAS, Ozawa és iteratív módszerek alapján kiszámítottuk a Kaol/alkilamin interkalációs vegyületek aktiválási energiájának E eredményeit. A Kaolpi/HA, Kaolpi/DA és Kaolpi/OA átlagos aktiválási energiája E 104,44, 130,80 és 154,59 kJ mol-1. Az átlagos aktiválási energia E a Kaol/alkilamin vegyületek között pozitív korrelációt mutat az alkillánc hosszával. A Kaol/alkilamin bomlási folyamatának optimalizált mechanizmusfüggvényét 3D diffúzióként határoztuk meg G(α) = 2 integrálfüggvénnyel. Ez a kutatás előnyös az agyag/szerves nanokompozitok bomlási mechanizmusának jobb megértéséhez, emellett inspirációt nyújt új agyagalapú anyagok szintéziséhez.
Author Contributions
HC és QfL tervezte a kísérletet és átdolgozta a cikket. YZ, QhL és PX végezték a kísérleteket és írták a tanulmányt. YZ és QhL egyenlő mértékben járultak hozzá a munkához.
Interdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
Dr. Luyi Sun (Department of Chemical and Biomolecular Engineering and Polymer Program, Institute of Materials Science, University of Connecticut) munkájának átdolgozásáért köszönet illeti. A szerzők hálásan köszönik a Kínai Nemzeti Természettudományi Alapítvány (41602171), a Pekingi Természettudományi Alapítvány (8164062) és a Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing által nyújtott pénzügyi támogatást.
Giese, R., and Datta, P. (1973). Hidroxilorientáció kaolinitban, dickitben és nakritban. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). Fourier transzformációs infravörös spektrometria. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., and Guggenheim, S. (1985). A kaolinit dehidroxilálása. Am. Mineral. 70, 1-2.
Google Scholar
Vélemény, hozzászólás?