Az ammóniával való reakcióban miért a víz a sav?
Ez egy nagyszerű általános kémiai reakció fontos szerves kémiai vonatkozásokkal. Egy másik hasonló kérdés, hogy miért bázis a víz, ha egy “savval” reagál? A válasz mindkét kérdésre: minden relatív! Itt a StudyOrgo-nál gyakran kapunk ilyen kérdéseket a szerves kémia olyan témáival kapcsolatban, amelyek általában gyorsan le vannak fedve, rosszul vannak leírva, vagy elvárható, hogy korábbi kurzusokból ismerje őket. Ezek a fogalmak igazán fontosak a következő, összetettebb témák megértéséhez. A StudyOrgo tagsággal még több tippet és trükköt kap a szerves kémia témáival kapcsolatban, valamint részletes mechanizmusokat magyarázatokkal. A mai blog a rendelkezésre álló részletes témák és anyagok előzetese. Tekintse meg a StudyOrgo.com tagságot, és iratkozzon fel még ma!
Memlékezzen arra, hogy a savak és bázisok tekintetében két definíció létezik; a Bronsted- és a Lewis-definíció. A Bronsted-savakat protondonorként, míg a Lewis-savakat elektronakceptorként definiálják. Mindkettő sav, de amit másképp gondolunk, az az, hogy protonokról vagy elektronokról van szó. Vizes oldatban, általános kémiában vagy biokémiában elsősorban a Bronsted-definícióra gondolunk, mivel a savakból származó protonok disszociációja megváltoztatja az oldat H+ koncentrációját, amit a pH változásaként és az oldat “savasságaként” értelmezünk. A savakból történő protonok disszociációját, illetve a bázisok által történő protonfelvételt egy számértékkel mérjük, amely a pKa. Minél nagyobb a pKa, annál gyengébb a sav és annál erősebb a bázis. Minél kisebb a pKa, annál erősebb a sav és gyengébb a bázis. Egy egyszerű trükk a pKa gondolkodásához, ha a molekula protonált változatát balra helyezzük, és protondonorként gondolunk rá. A pKa megmondja, hogy mennyire lesz könnyű ez a donáció, minél alacsonyabb a szám, annál könnyebb a protonadományozás.
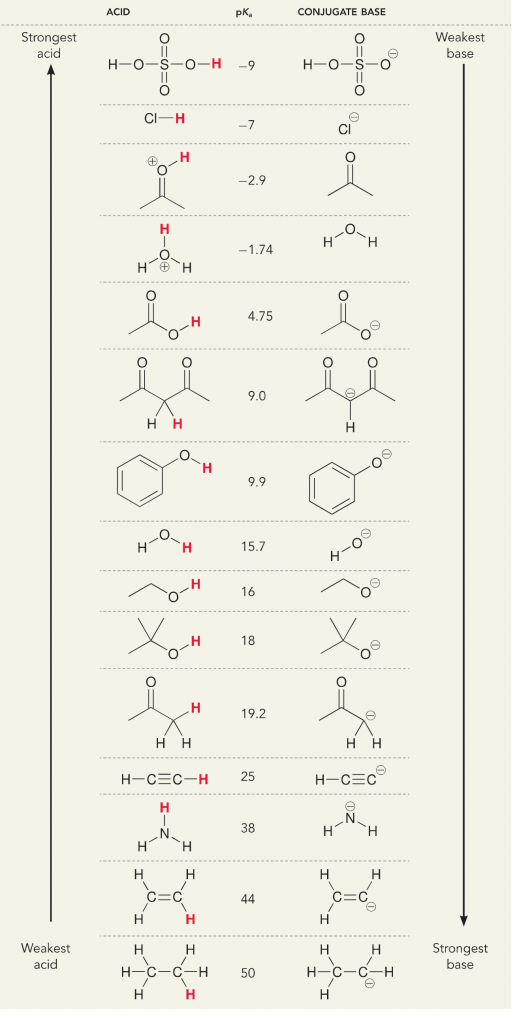
Nézzük meg az ammónia és a víz reakcióját; a víz pKa értékét 14-ben határozzuk meg. Az ammónia pKa értéke ~37.
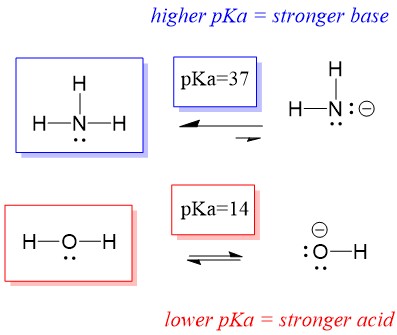
Ezért, mivel a víz pKa értéke alacsonyabb, mint az ammóniaé, erősebb sav az ammónia, és protonokat adományoz az ammónia bázisának. E reakció hatására a víz OH- konjugált bázissá, az ammónia pedig NH4+ konjugált savvá válik. Érdekes módon az ammónia ezért marószer, hidroxidot termel, amely reakcióba lép a foltokkal és a mikroorganizmusokkal, így hatékonyan tisztítja és fertőtleníti a háztartási tárgyakat.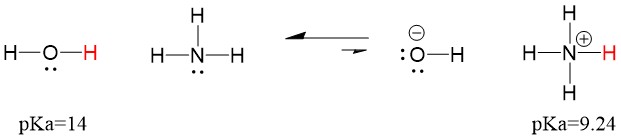
Ez azért fontos szerves kémiai fogalom, mert a savak és bázisok erőssége az elektronok szempontjából, vagyis a Lewis-féle definíció pontosan az, ahogyan a kötésbontási és kötésképzési mechanizmusokról gondolkodunk; az elektronok áramlása. A Lewis-savak és a konjugált savak erőssége segíthet meghatározni, hogy egy reakció melyik irányba fog haladni. Láthatjuk, hogy a víz an ammónia reakciója kedvezőtlen, de a valóságban elég reakció megy végbe ahhoz, hogy a víz pH-ja jelentősen csökkenjen (pH~11 ammóniával).
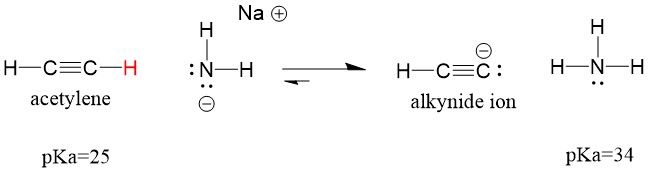
Nézzük meg, hogy egy acetilén reakcióba lép egy bázissal, hogy alkinidiont hozzon létre, ami hasznos nukleofil a C-C kötés kialakulásához. Ha nátrium-hidroxidot próbálunk alkinnal reagáltatni, alkinidion NEM keletkezik. Ennek az az oka, hogy a reakció konjugált sav terméke a víz, amelynek pKa értéke 15, ERŐsebb, mint az eredeti savas acetilén (pKa = 25). A reakciók MINDIG a gyengébb sav, vagy ebben az esetben a reagáló fél képződésének kedveznek.
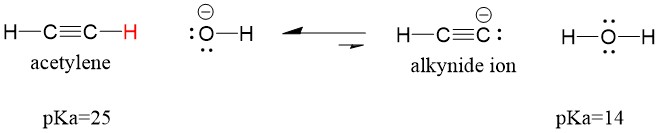
Ha a bázisunkat nátrium-amidra cseréljük, ami egy sokkal erősebb bázis, alkünidion fog keletkezni. Ennek az az oka, hogy a reakció konjugált sav terméke az ammónia, amelynek pKa értéke 38, és gyengébb konjugált sav, mint az eredeti sav, az acetilén (pKa = 25). Ebben az esetben a reakció a termékoldalnak kedvez!

Vélemény, hozzászólás?