Ebben az útmutatóban lépésről lépésre megrajzoljuk a karbonátion Lewis-szerkezetét. A CO32- Lewis-szerkezetének megrajzolásához a teljes valenciaelektronok fogalmát használjuk. A CO32- lewis szerkezetének befejezése után -2 töltésnek és stabilitásnak kell lennie. Ezekről a dolgokról ebben az oktatóanyagban fogsz tanulni.
- Karbonátion | CO32-
- CO32- Lewis szerkezet
- A CO32- lewis szerkezet rajzolásának lépései
- A CO32- valenciahéjak elektronjainak összesített száma
- A valenciaelektron-párok összesen
- A CO32- ion centrális atomja
- Magányos párok az atomokon
- Atomok töltései
- A stabilitás ellenőrzése és az atomok töltéseinek minimalizálása a magányos párok kötéssé alakításával
- A CO32- (karbonát) ion Lewis-szerkezete
- karbonát Lewis-szerkezete és bikarbonát Lewis-szerkezete
Karbonátion | CO32-
A karbonátionnak -2 töltése van. A fémkarbonátvegyületek gyakoriak a világon. Mint egy CaCO3 adható meg.
CO32- Lewis szerkezet
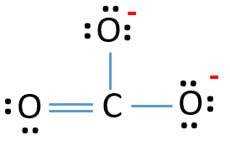
A CO32- ion Lewis szerkezetében három σ kötés és π kötés van a szénatom körül.
A CO32- lewis szerkezet rajzolásának lépései
A CO32- lewis szerkezet rajzolásához a következő lépések szükségesek, amelyeket ebben a tananyagban részletesen ismertetünk.
- A szén- és oxigénatomok valenciahéjainak összes elektronszámának meghatározása
- Elektronpárok összessége
- Az atomok középpontjának kiválasztása
- Magányos párok elhelyezése az atomokon
- A stabilitás ellenőrzése és az atomok töltésének minimalizálása a magányos párok kötéssé alakításával.
A helyes Lewis-szerkezet megrajzolása fontos a CO32- rezonanciaszerkezetének helyes megrajzolásához.
A CO32- valenciahéjak elektronjainak összesített száma
A szén a periódusos rendszer 4. csoportjában található. Tehát a szénnek négy elektron van a valenciahéjában.Az oxigén a 6. csoportban található. Hat elektronja van a valenciahéjban.
- A szénatom által adott összes valenciaelektron = 4
A CO32- ionban három oxigénatom van, Ezért
- Az oxigénatomok által adott összes valenciaelektron = 6 *3 = 18
A CO32- ionon -2 töltés van. Ezért van még két elektron, amely hozzájárul a valenciaelektronokhoz.
- A valenciaelektronok összesen = 4 + 18 + 2 = 24
A valenciaelektron-párok összesen
A valenciaelektron-párok összesen = σ kötések + π kötések + magányos párok a valenciahéjakon
A valenciaelektron-párok számát úgy határozzuk meg, hogy az összes valenciaelektronok számát elosztjuk kettővel. A CO32- ion esetében az összes elektronpár 12.
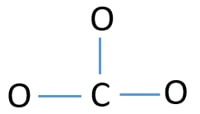
A CO32- ion centrális atomja
Azért, hogy centrális atom legyen, fontos, hogy nagyobb valenciával rendelkezzen. A szénnek nagyobb esélye van arra, hogy a központi atom legyen (lásd az ábrát), mert a szén 4-es valenciát tud felmutatni. Az oxigén legnagyobb valenciája 2. Így most felépíthetjük a CO32- ion vázlatát.
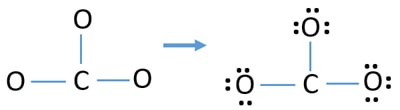
Magányos párok az atomokon
- A fenti vázlatban már három C-O kötés van. Ezért már csak kilenc (12-3 = 9) valenciaelektron-pár marad.
- Először is jelöljük meg ezt a kilenc valenciaelektron-párt magányos párként a külső atomokon (oxigénatomokon). Egy oxigénatom a nyolcas szabály szerint (az oxigénatom nem tarthat nyolcnál több elektront a valenciahéjában) három magányos párt vesz fel.
- Három oxigénatom esetén kilenc elektronpár fogy el. Most már nincs több magányos pár, amit az oxigénatomokon való jelölés után a szénatomokon (külső atomokon) meg kell jelölnünk.
Atomok töltései
Az atomok elektronpárjainak jelölése után meg kell jelölnünk az egyes atomok töltéseit. A töltések jelölése azért jelentős, mert ennek segítségével határozzuk meg az ion legjobb lewis szerkezetét. A töltések megjelölése után látni fogjuk, hogy minden oxigénatom -1 töltést, a szénatom pedig +1 töltést kap.
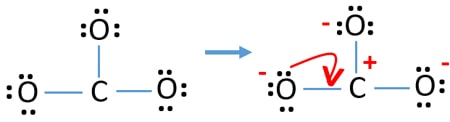
A stabilitás ellenőrzése és az atomok töltéseinek minimalizálása a magányos párok kötéssé alakításával
- Az oxigénatomoknak negatív töltést kell tartaniuk, mert az oxigénatom elektronegativitása nagyobb, mint a szénatomé. Máskülönben azt mondhatjuk, hogy az oxigénatomok negatív töltések megtartásának képessége nagyobb, mint a szénatomoké.
- A rajzolt szerkezet nem stabil, mert minden atomnak van töltése (a Lewis szerkezetnek stabilnak kellene lennie, kevesebb töltéssel).
- Most meg kell próbálnunk minimalizálni a töltéseket a magányos párok vagy párok kötésekké alakításával. Tehát egy oxigénatom egy magányos párját alakítsuk át C-O kötéssé.
- Most van egy kettős kötés a szénatom és egy oxigénatom között (egy C=O kötés). Most két egyszerű kötés van a szénatom és a másik két oxigénatom között (két C-O kötés).
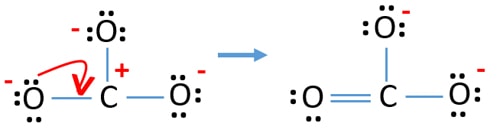
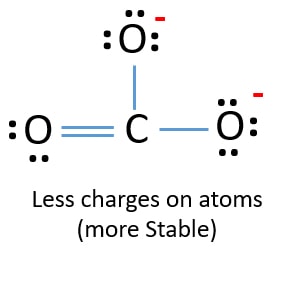
Az új szerkezetben az atomok töltései csökkentek az előző szerkezethez képest. Most már nincs töltés az egyik oxigénatomon és a szénatomon. Továbbá csak két oxigénatomnak van -1 negatív töltése. Most már érted, hogy ez a CO32- szerkezet stabilabb, mint az előző szerkezet. Tehát ennek a szerkezetnek nagyobb esélye van arra, hogy a CO32- ion Lewis-szerkezete legyen.
A CO32- (karbonát) ion Lewis-szerkezete
Kérdések
Tegye fel kémiai kérdéseit és találja meg a válaszokat
karbonát Lewis-szerkezete és bikarbonát Lewis-szerkezete
A karbonátionban két oxigénatom van, amelyek mindegyikén -1 töltés van. Az egyik oxigénatom egy protont vesz fel (H+ ion) és egy -OH csoportot képez.
Kapcsolódó oktatóanyagok
Vélemény, hozzászólás?