A 13. csoport elemei közé tartoznak az átmenet utáni fémek.
Az átmenet utáni fémek kifejezés azokra az elemekre utal, amelyek az átmeneti fémeket követő fémek. A metalloid fogalomhoz hasonlóan nincs általános konszenzus abban, hogy pontosan mi is az átmenet utáni fém. Szerencsére a gyakorlatban kevésbé fontos pontosan meghatározni, hogy mi az átmenet utáni fém és mi nem az, mint annak megértése, hogy miért lehet hasznos az elemeket az átmenet utáni fémek közé sorolni.
A poszt-átmeneti fémek fő jellemzője, hogy viszonylag elektronban gazdagok és elektronegatívak ahhoz képest, amit klasszikusan fémnek gondolunk. Nagyjából ez viszonylag alacsonyabb olvadáspontokat jelent (mivel a sávszerkezetben több kötésellenes szint szokott elfoglalva lenni), a kovalens kötések fokozott preferálását és a többi fémhez képest nagyobb törékenységet (az ebből eredő irányított kötések miatt). Elektrongazdagságuk azt jelenti, hogy hajlamosak lágy kationokat képezni.
Az elemeknek az átmenet utáni fémekhez való tartozására több rendszert is használnak. A legfontosabbak a következők:
- A d-blokkot követő fémek. E meghatározás szerint csak a 13. és magasabb csoportokba és a 3. és magasabb sorokba tartozó fémek tartoznak ide, amelyek viszonylag lágy és elektronban gazdag kationokat alkotnak, és kötéseikben jelentős kovalenciát mutatnak. Ha azonban ezt a sémát túl szigorúan fogadjuk el, az Al ki van zárva, mivel technikailag nem követi a d-blokkot (és töltetlen (n-1)d alhéjjal rendelkezik), és a metalloidok is ki vannak zárva, annak ellenére, hogy sokan közülük szintén viszonylag lágy és elektronokban gazdag kationokat képeznek, töltött (n-1)d alhéjjal. Ennek a rendszernek egy másik hátránya, hogy összekeveri azt a kérdést, hogy mely elemeket kell az átmenet utáni fémek közé sorolni, azzal a kényes kérdéssel, hogy mely elemeket kell a fémek vs. metalloidok közé sorolni.
- A p-blokk fémei és metalloidjai. Ennek a rendszernek az az előnye, hogy kiemeli a p-blokk fémek és metalloidok érdekes és egyedi tulajdonságait, valamint e tulajdonságok folytonosságát a p-blokkban. Következésképpen ezt fogjuk használni a következő szakaszokban. Hátránya azonban, hogy kizárja az olyan fémeket, mint a Zn, a Cd és a Hg, amelyek számos olyan vegyületet alkotnak, amelyekben a fém (n-1)d10 konfigurációjú.
- Az Al és a p-blokk metalloidjai mellett néha olyan fémek is előfordulnak, amelyek az átmeneti elemeket követik abban az értelemben, hogy teljesen teljes (n-1)d valenciahéjjal rendelkező ionokat alkotnak. Ez a meghatározás a Zn-t, a Cd-t és a Hg-t (és néha a Cu-t, Ag-t és Au-t) is hozzáadja, mivel ezek (n-1)d 10 valenciaelektron-konfigurációjú ionokat képeznek, mint például a Zn2+, Cd2+ és Hg2+ (és Cu+, Ag+ és Au+). Mivel ez a fejezet csak a p-blokk elemeit veszi figyelembe, a fejezet céljaira ez a rendszer funkcionálisan azonos a 2. rendszerrel.
Bármelyik osztályozási sémát is használjuk, gyakran hasznosabb az elemek átmenet utáni fémekként való osztályozására úgy gondolni, mint az elemek egy halmazának kémiai tulajdonságai közötti hasonlóságok hangsúlyozására, mint annak hangsúlyozására, hogy miben különböznek az átmenet utáni fémek más fémektől. Nem az átmenet utáni fémek az egyetlenek, amelyek lágy kationokat vagy olyan vegyületeket alkotnak, amelyeket inkább kovalens kötések tartanak össze. Amint az előző szakaszok világossá tették, még az alkálifémek is képeznek anionokat a megfelelő körülmények között, és a fémek számos vegyülete jobban leírható kovalens, mint ionos kölcsönhatásokkal. Ez már az előző szakaszban tárgyalt Be és Mg alkáliföldfémek kémiájában is nyilvánvaló volt. A következő fejezetekben a koordinációs komplexek és fémorganikus vegyületek kötéseit és reakcióképességét nagyrészt kovalens fogalmakkal írjuk le.
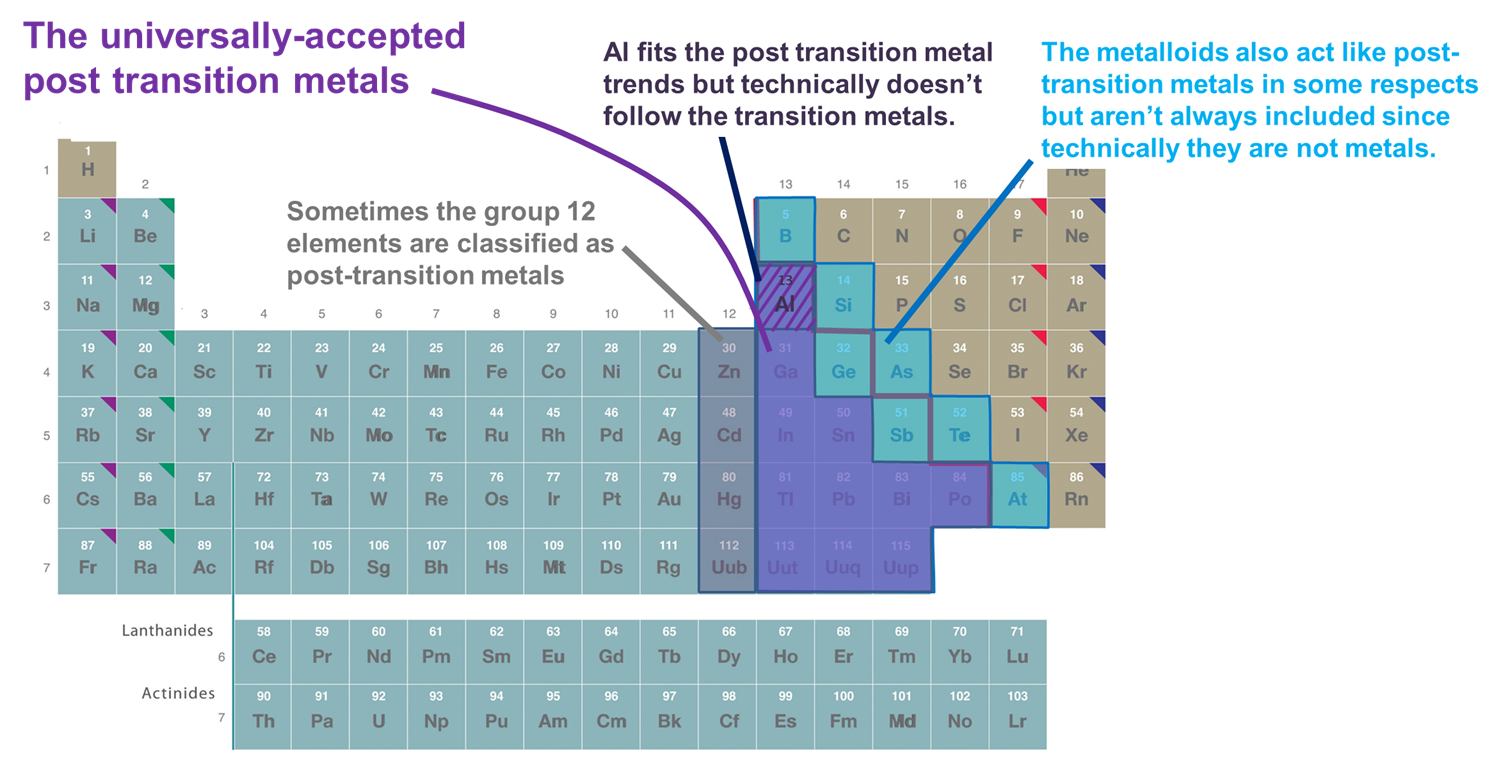
Ábra \(\sf{\PageIndex{2}}\). Néhány az átmenet utáni fémek közé sorolt elemek közül. A lilával ábrázoltakat általában elfogadják, mivel ezek fémek, és egyértelműen az átmeneti fémeket követik, míg a 12. (és néha a 11.) csoportba tartozó fémek, az Al és a metalloidok néha mind ide tartoznak, mivel fontos tekintetben úgy viselkednek, mint a többi átmenet utáni fém. A periódusos rendszer a https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molecules%2C_and_Ions/2.5%3A_The_Periodic_Table.
alatti táblázatból lett átvéve.
Vélemény, hozzászólás?