Molekuláris dipólusmomentumok
Egynél több poláris kötést tartalmazó molekulákban a molekuláris dipólusmomentum nem más, mint az egyes “kötési dipólusmomentumoknak” tekinthető molekulák vektoros kombinációja. Matematikailag a dipólusmomentumok vektorok; nagyságuk és irányuk is van. A molekula dipólusmomentuma tehát a molekula egyes kötései dipólusmomentumainak vektoros összege. Ha az egyes kötések dipólusmomentumai kioltják egymást, akkor nincs nettó dipólusmomentum. Ez a helyzet a CO2 esetében, amely egy lineáris molekula (\(\PageIndex{1a}\) ábra). A CO2 minden C-O kötése poláris, mégis a kísérletek azt mutatják, hogy a CO2 molekulának nincs dipólusmomentuma. Mivel a CO2 két C-O kötés dipólusa egyenlő nagyságú és 180°-ban van egymáshoz képest, ezek kioltják egymást. Ennek eredményeként a CO2-molekulának nincs nettó dipólusmomentuma, annak ellenére, hogy jelentős töltéskülönbséggel rendelkezik. Ezzel szemben a H2O molekula nem lineáris (\(\PageIndex{1b}\) ábra); a háromdimenziós térben meghajlik, így a dipólusmomentumok nem oltják ki egymást. Így egy olyan molekulának, mint a H2O, nettó dipólusmomentuma van. Azt várjuk, hogy a negatív töltés koncentrációja az oxigénen, az elektronegatívabb atomon van, a pozitív töltés pedig a két hidrogénen. Ez a töltéspolarizáció teszi lehetővé, hogy a H2O hidrogénkötést létesítsen más polarizált vagy töltött fajokkal, köztük más vízmolekulákkal.
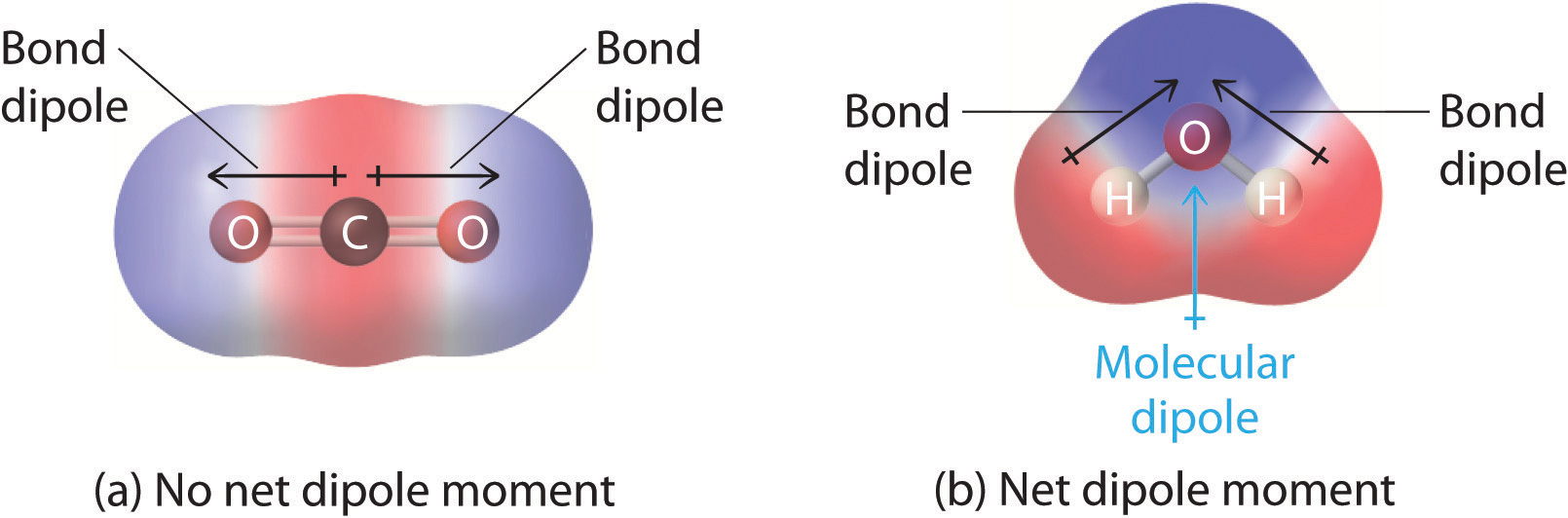
Ábra \(\PageIndex{1}\): Hogyan adódnak össze az egyes kötési dipólusmomentumok, hogy két különböző szerkezetű háromatomos molekula teljes molekuláris dipólusmomentumát kapjuk. (a) A CO2-ben a C-O kötés dipólusai azonos nagyságúak, de ellentétes irányban (180°-ban) helyezkednek el. Vektorösszegük nulla, így a CO2-nak nincs nettó dipólusa. (b) A H2O-ban az O-H kötés dipólusai szintén egyenlő nagyságúak, de 104,5°-kal irányulnak egymáshoz képest. Ezért a vektorösszeg nem nulla, és a H2O-nak nettó dipólusmomentuma van.”
A következő egy egyszerűsített egyenlet egy egyszerű elválasztott két töltéses rendszerre, amely kétatomos molekulákban vagy a molekulán belüli kötésdipólus figyelembevételekor van jelen.
\
Ez a kötési dipólus, µ (görögül mu) a \(Q^+\) és \(Q^-\) parciális töltések (vagy a gyakrabban használt \(δ^+\) – \(δ^-\)) közötti \(r\) távolságon keresztüli töltésleválásból származó dipólusként értelmezhető; a dipólus orientációja a kötés tengelye mentén van. A dipólusmomentumok mértékegységei általában debye (D), ahol egy debye 3,336 x 1030 coulombméter (C – m) SI-egységben. Tekintsünk egy egyszerű, egyetlen elektronból és protonból álló rendszert, amelyet egy fix távolság választ el egymástól. Egy elektron egységnyi töltése 1,60 X 1019 C és a proton & elektronja 100 pm távolságra van egymástól (körülbelül egy tipikus kovalens kötés hossza), a dipólusmomentum a következőképpen számítható ki:
\ &= (1,60 \szer 10^{-19}\, C)(1,00 \szer 10^{-10} \,m) \nemszám \\\ &= 1,60 \szer 10^{-29} \,C \cdot m \label{2} \end{align}\]
\ &= 4.80\; D \label{3} \end{align}\]
\(4.80\; D\) egy kulcsfontosságú referenciaérték, és a +1 és -1 tiszta töltés 100 pm-rel elválasztva. Ha azonban a töltésszeparációt növelnénk, akkor a dipólusmomentum (lineárisan) nő:
- Ha a proton és az elektron 120 pm-rel lenne elválasztva egymástól:
\
- Ha a protont és az elektront 150 pm választaná el:
\
- Ha a protont és az elektront 200 pm választaná el:
\
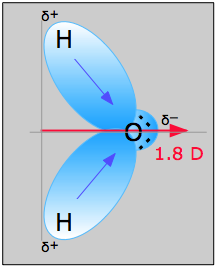
Példa \(\PageIndex{1}\): \(\PageIndex{1}\) ábrán látható vízmolekula segítségével meghatározható a dipólusmomentum iránya és nagysága. Az oxigén és a hidrogén elektronegativitásából a különbség a hidrogén-oxigén kötések mindegyikénél 1,2e. Ezután, mivel az oxigén az elektronegatívabb atom, nagyobb vonzerőt gyakorol a közös elektronokra; két magányos elektronpárral is rendelkezik. Ebből arra következtethetünk, hogy a dipólusmomentum a két hidrogénatom között az oxigénatom felé mutat. A fenti egyenlet segítségével a dipólusmomentum értéke 1,85 D, ha az oxigén- és a hidrogénatomok közötti távolságot megszorozzuk a köztük lévő töltéskülönbséggel, majd megkeressük az egyes komponenseket, amelyek a nettó dipólusmomentum irányába mutatnak (a molekula szöge 104 .5˚).
Az O-H kötés kötési nyomatéka =1,5 D, tehát a nettó dipólusmomentum
\
.
Vélemény, hozzászólás?