Bonding in acetylene
Végezetül, a hibrid orbitál fogalma jól alkalmazható a hármas kötésű csoportokra, mint például az alkinek és a nitrilek. Vegyük például a legegyszerűbb alkin, az etin (közismert nevén acetilén) szerkezetét.
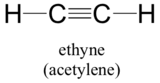
Ez a molekula lineáris: mind a négy atom egyenes vonalban fekszik. A szén-szén hármas kötés mindössze 1,20Å hosszú. Az acetilén hibrid orbitális képén mindkét szén sp-hibridizált. Egy sp-hibridizált szénben a 2s orbitális a 2px orbitálissal egyesülve két sp hibrid orbitált alkot, amelyek 180°-os szögben állnak egymáshoz képest (pl. az x tengely mentén). A 2py és 2pz orbitálok nem hibridizáltak maradnak, és az y, illetve a z tengely mentén merőlegesen orientálódnak.


A C-C szigma kötés tehát az egyes szénatomok egy-egy sp orbitáljának átfedésével jön létre, míg a két C-H szigma kötés az egyes szénatomok második sp orbitáljának és egy hidrogén 1s orbitáljának átfedésével jön létre. Minden szénatom még mindig rendelkezik két félig kitöltött 2py és 2pz orbitállal, amelyek egymásra és a szigma kötések által alkotott vonalra merőlegesek. Ez a két egymásra merőleges p-p-pár két pi-kötést képez a szénatomok között, ami összességében hármas kötést eredményez (egy szigma- és két pi-kötés).

A hibrid orbitális fogalma szépen magyaráz egy másik kísérleti megfigyelést: a kettős és hármas kötésekkel szomszédos egyszerű kötések fokozatosan rövidebbek és erősebbek, mint a “normál” egyszerű kötések, például az egyszerű alkánokban. Az etánban lévő szén-szén kötés (az alábbi A szerkezet) két sp3-orbitális átfedéséből származik.

A B alkénben azonban a szén-szén egyszálas kötés egy sp2 és egy sp3 orbitál átfedésének eredménye, míg a C alkénben a szén-szén egyszálas kötés egy sp és egy sp3 orbitál átfedésének eredménye. Ezek mind egyszerű kötések, de a C molekulában lévő kötés rövidebb és erősebb, mint a B molekulában lévő, amely viszont rövidebb és erősebb, mint az A molekulában lévő.
A magyarázat itt viszonylag egyszerű. Egy sp orbitál egy s és egy p orbitálból áll, tehát 50%-ban s és 50%-ban p karakterrel rendelkezik. az sp2 orbitálok ehhez képest 33%-ban s és 67%-ban p karakterrel rendelkeznek, míg az sp3 orbitálok 25%-ban s és 75%-ban p karakterrel. Gömb alakjuk miatt a 2s pályák kisebbek, és a 2p pályákhoz képest közelebb és “szorosabban” tartják az elektronokat az atommaghoz. Következésképpen az sp + sp3 átfedéssel járó kötések (mint az alkén C-ben) rövidebbek és erősebbek, mint az sp2 + sp3 átfedéssel járó kötések (mint az alkén B-ben). Az sp3-sp3 átfedéssel járó kötések (mint az alkán A-ban) a leghosszabbak és leggyengébbek a csoportból, a hibridek 75%-os “p” jellege miatt.
Vélemény, hozzászólás?