14.8 Éterek
Tanulási célok
- Írd le az alkohol és az éter közötti szerkezeti különbséget, amely befolyásolja a fizikai tulajdonságokat és a reakcióképességet.
- Nevezd meg az egyszerű étereket.
- Írd le egyes éterek szerkezetét és felhasználási területeit.
Az általános képlettel ROR′, éterEgy olyan szerves vegyület, amelyben két szénhidrogéncsoport között egy oxigénatom van. a víz olyan származékának tekinthető, amelyben mindkét hidrogénatomot alkil- vagy arilcsoportok helyettesítik. Az alkohol (ROH) olyan származékának is tekinthető, amelyben az OH-csoport hidrogénatomját egy második alkil- vagy arilcsoporttal helyettesítették:
HOH→H atomokhelyett mindkétROR′←az OH-csoportH atomhelyettROH
Az egyszerű éterek egyszerű köznevei az oxigénatomhoz kapcsolódó csoportok nevéből, majd az éter gyűjtőnevéből állnak. Például a CH3-O-CH2CH2CH2CH3 a metil-propiléter. Ha mindkét csoport azonos, a csoportnév elé a di- előtagot kell tenni, mint a dimetil-éter (CH3-O-CH3) és a dietil-éter CH3CH2-O-CH2CH3.
Az éter molekuláknak nincs hidrogénatomjuk az oxigénatomon (azaz nincs OH-csoportjuk). Ezért az étermolekulák között nincs intermolekuláris hidrogénkötés, ezért az étereknek adott moláris tömeghez képest meglehetősen alacsony a forráspontjuk. Valójában az éterek forráspontja nagyjából megegyezik a hasonló moláris tömegű alkánokéval, és sokkal alacsonyabb, mint a megfelelő alkoholoké (14.4. táblázat “Az alkánok, alkoholok és éterek forráspontjainak összehasonlítása”).
14. táblázat.4 Alkanok, alkoholok és éterek forráspontjainak összehasonlítása
| Sűrített szerkezeti képlet | Név | Moláris tömeg | Fulladási pont (°C) | Intermolekuláris hidrogénkötés tiszta folyadékban? |
|---|---|---|---|---|
| CH3CH2CH3 | propán | 44 | -42 | nem |
| CH3OCH3 | dimetil-éter | 46 | -25 | nem |
| CH3CH2OH | etil-alkohol | 46 | 78 | igen |
| CH3CH2CH2CH2CH3 | pentán | 72 | 36 | nem |
| CH3CH2OCH2CH3 | dietil-éter | 74 | 35 | nem |
| CH3CH2CH2CH2OH | butil-alkohol | 74 | 117 | igen |
Az éter molekuláknak van egy oxigénatomjuk, és hidrogénkötést létesítenek a vízmolekulákkal. Következésképpen egy éter körülbelül ugyanolyan oldhatósággal rendelkezik vízben, mint a vele izomerikus alkohol. Például a dimetil-éter és az etanol (mindkettő molekulaformulája C2H6O) teljesen oldódik vízben, míg a dietil-éter és az 1-butanol (mindkettő C4H10O) alig oldódik vízben (8 g/100 ml víz).
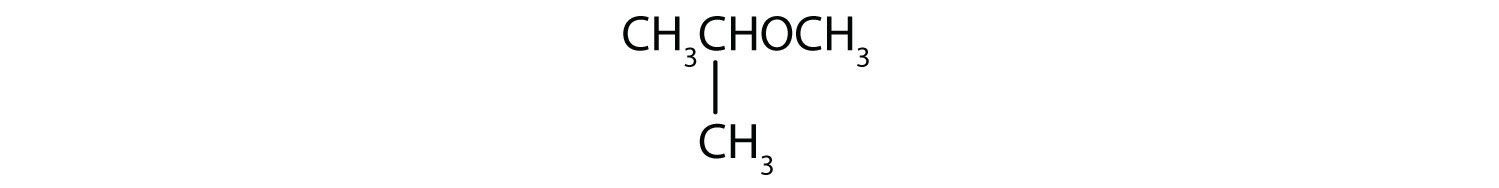
Példa 5
Mi az egyes éterek közismert neve?
- CH3CH2CH2OCH2CH2CH2CH3
-
Az oldat
- Az oxigénatom két oldalán lévő széncsoportok propil (CH3CH2CH2) csoportok, tehát a vegyület dipropil-éter.
- A három szénatomos csoport a középső szénatomon keresztül kapcsolódik, tehát izopropil-csoportról van szó. Az egy szénatomos csoport egy metilcsoport. A vegyület izopropil-metil-éter.
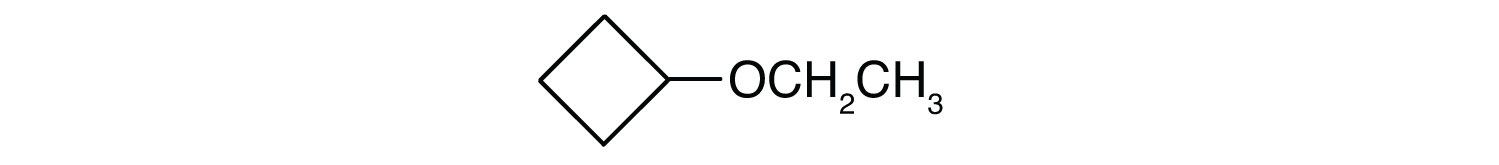
Készségfejlesztő gyakorlat
-
CH3CH2CH2CH2OCH2CH2CH2CH2CH2CH3
-
Az egészségedre: Az éterek mint általános érzéstelenítők
Az általános érzéstelenítő úgy hat az agyra, hogy eszméletvesztést és általános érzéketlenséget eredményez az érzésekkel vagy fájdalommal szemben. A dietil-éter (CH3CH2OCH2CH3) volt az első alkalmazott általános érzéstelenítő.
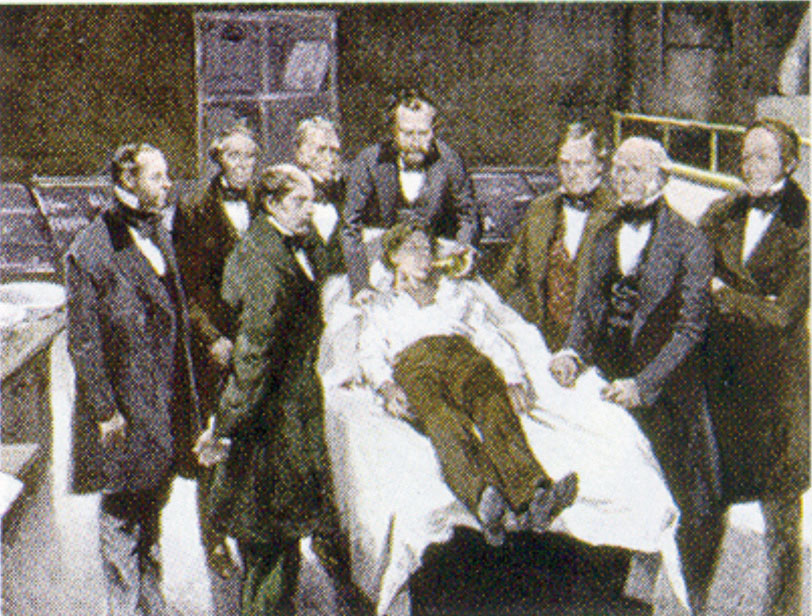
William Morton bostoni fogorvos 1846-ban vezette be a dietil-étert a sebészeti gyakorlatba. Ez a festmény egy 1846-os bostoni műtétet ábrázol, ahol a dietil-étert használták érzéstelenítőként. Az étergőz belélegzése a központi idegrendszer aktivitásának csökkentésével eszméletvesztést okoz.
Forrás:
A dietil-éter viszonylag biztonságos, mivel a hatékony érzéstelenítést eredményező dózis és a halálos dózis között meglehetősen nagy a különbség. Mivel azonban erősen gyúlékony és további hátránya, hogy hányingert okoz, felváltották az újabb inhalációs anesztetikumok, köztük a fluortartalmú halotán, enflurán és izoflurán vegyületek. Sajnos ezeknek a vegyületeknek a biztonságossága a műtőben dolgozó személyzet számára megkérdőjeleződött. Például a halotánnak kitett műtősnőknél magasabb a vetélések aránya, mint az általános populációban élő nőknél.
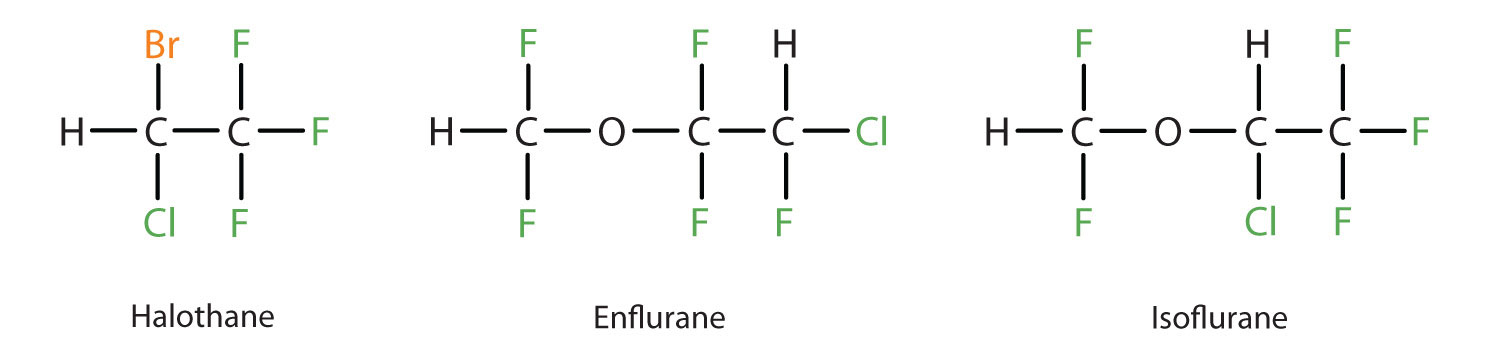
Ez a három modern, inhalatív, halogéntartalmú érzéstelenítő vegyület kevésbé gyúlékony, mint a dietil-éter.
Koncepció áttekintő gyakorlatok
-
Miért van a dietil-éter (CH3CH2OCH2CH3) forráspontja sokkal alacsonyabb, mint az 1-butanolé (CH3CH2CH2CH2CH2OH)?
-
Melyik oldódik jobban vízben – az etil-metil-éter (CH3CH2OCH3) vagy az 1-butanol (CH3CH2CH2CH2CH2OH)? Magyarázza meg.
Válaszok
-
A dietil-éterben nincs intermolekuláris hidrogénkötés, mert nincs OH-csoport; az 1-butanolban van OH és részt vesz intermolekuláris hidrogénkötésben.
-
A metil-etiléter (három szénatom, egy oxigénatom) jobban oldódik vízben, mint az 1-butanol (négy szénatom, egy oxigénatom), bár mindkettő képes hidrogénkötést létesíteni a vízzel.
Főbb tanulságok
- Az éterek köznapi elnevezéséhez egyszerűen nevezzük meg az oxigénatomhoz kapcsolódó csoportokat, majd az éter gyűjtőnevet. Ha mindkét csoport azonos, a csoportnév elé a di- előtagot kell tenni.
- Az éter molekuláknak nincs OH-csoportjuk, így nincs molekulák közötti hidrogénkötésük sem. Az étereknek ezért adott moláris tömeghez képest meglehetősen alacsony a forráspontjuk.
- Az éter molekuláknak van egy oxigénatomjuk, és képesek hidrogénkötést létesíteni vízmolekulákkal. Egy étermolekula körülbelül ugyanolyan oldhatóságú vízben, mint a vele izomerikus alkohol.
Feladatok
-
Hogyan adhat az etanol két különböző terméket, ha kénsavval melegítjük? Nevezze meg ezeket a termékeket.
-
Melyik éter izomer az etanol-CH3CH2OCH2CH3, CH3OCH2CH3 vagy CH3OCH3 etanollal?
-
Nevezze meg az egyes vegyületeket.
- CH3OCH2CH2CH3
-
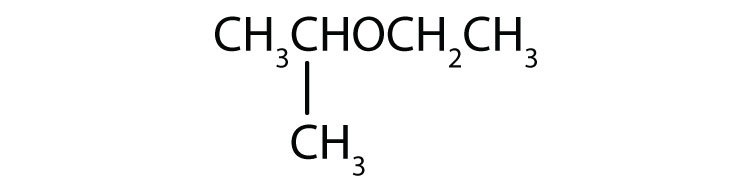
-
Nevezze meg az egyes vegyületeket.
- CH3CH2CH2CH2CH2OCH3
- CH3CH2OCH2CH2CH2CH3
-
Rajzolja le az egyes vegyületek szerkezetét!
- metil-etiléter
- tert-butil-etiléter
-
Rajzolja le az egyes vegyületek szerkezetét.
- diizopropil-éter
- ciklopropil-propil-éter
Válaszok
-
Intramolekuláris (a H és az OH ugyanabból a molekulából származik) dehidratációval etilént kapunk; intermolekuláris (a H az egyik molekulából, az OH pedig egy másik molekulából származik) dehidratációval dietil-étert kapunk.
-
- metil-propiléter
- etil-izopropil-éter
.
-
- CH3OCH2CH3
-
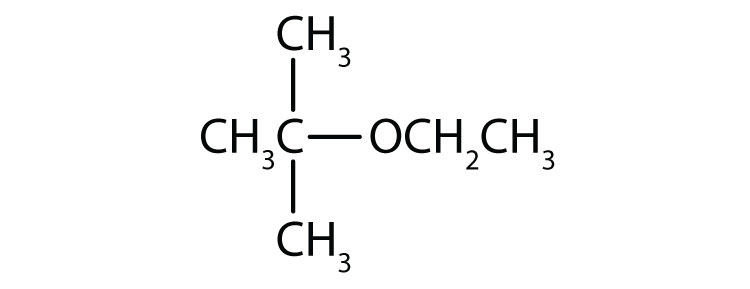
-
Mi az egyes éterek közismert neve?
Vélemény, hozzászólás?