Co je železo
Železo (vyslovuje se jako EYE-ren) je tvrdý kov s vysokou obchodní hodnotou, patřící do skupiny přechodných kovů. Představuje se chemickou značkou Fe a je chemicky reaktivní se sklonem ke snadné korozi na vzduchu, kdy na vlhkém vzduchu vytváří načervenalou vrstvu zvanou rez .

Symbol železa
Kde se železo nachází
Je to čtvrtý nejrozšířenější kov v zemské kůře, běžně spojený s dalšími minerálními rudami, jako je hematit, takonit a magnetit, které se nacházejí v důlních zásobách Ukrajiny, Brazílie, Ruska, Austrálie a Číny. Jeho komerční výroba se provádí ve vysoké peci zahříváním rudy koksem a vápencem .
Historie
Původ názvu:
Kdo ho objevil:
Kdy, kde a jak byl objeven
Předpokládá se, že kolem roku 3500 př. n. l. používali železné předměty Egypťané. Chetité z Malé Asie byli známí tím, že během roku 1500 př. n. l. tavili tento kov z jeho rud. V roce 1722 vydal francouzský entomolog René Antoine Ferchault de Réaumur knihu, v níž popsal význam různých slitin železa .

Kov železa
Identifikace |
|||
| Atomové číslo | 26 | ||
| Číslo CAS | 7439-89-.6 | ||
| Poloha v periodické tabulce prvků | Skupina | Období | Blok |
| 8 | 4 | d | |
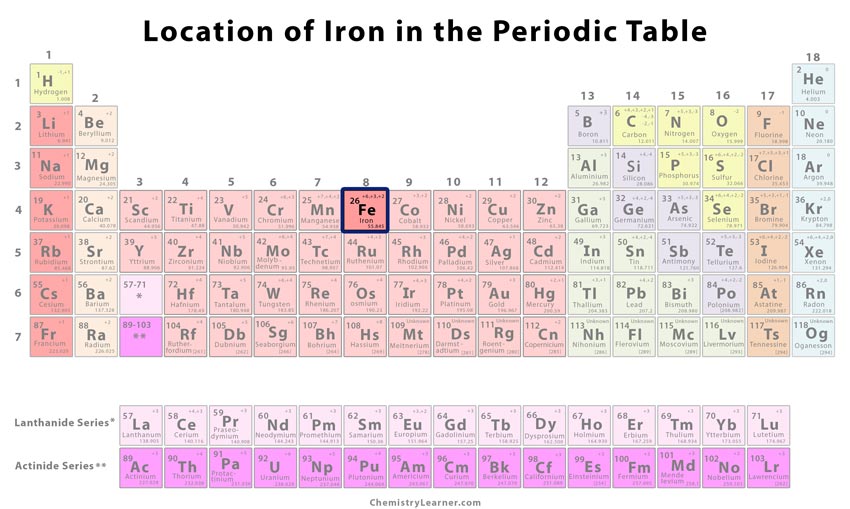
Kde je železo v periodické tabulce
Klasifikace, Vlastnosti a charakteristiky železa
Všeobecné vlastnosti |
||
| Relativní atomová hmotnost | 55.845 | |
| Atomová hmotnost/hmotnost | 55,845 atomových hmotnostních jednotek | |
| Molární hmotnost/molekulová hmotnost | 55.845 g/mol | |
| Masové číslo | 56 | |
Fyzikální vlastnosti |
||
| Barva/fyzikální vzhled | Stříbrošedá | |
| Teplota tání/teplota tuhnutí | 1538°C (2800°F) | |
| Teplota varu | 2861°C (5182°F) | |
| Hustota | 7.87 g/cm3 | |
| Standardní/přirozený stav při pokojové teplotě (pevná látka/kapalina/plyn) | Tvrdá látka | |
| Malátnost | Ano | |
| Tvrdost | Ano | |
| Tvrdost | 4-5 Mohs | |
| Specifická tepelná kapacita | 0.444 J g-1 oC | |
| Tepelná vodivost | 80.4 Wm-1K-1 | |
Chemické vlastnosti |
||
| Hořlavost | Není hořlavý | |
| Oxidační stavy (čísla) | 6, 3, 2, 0,-2 | |
Atomové údaje železa (prvek 26)
| Elektronová konfigurace (konfigurace vzácných plynů) | 3d64s2 | ||||||
| Atomová struktura | |||||||
| – Počet elektronů | 26 | ||||||
| – Počet neutronů | 30 | ||||||
| – Číslo Počet protonů | 26 | ||||||
| Poloměr atomu | |||||||
| – Atomový poloměr | 2.04 Å | ||||||
| – Kovalentní poloměr | 1.24 Å | ||||||
| Ionizační energie
(kJmol-)1) |
1. | 2. | 3. | 4. | 5. | 6. | 7. |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
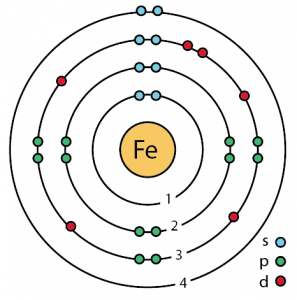
Struktura atomu železa (Bohrův model)
Jaké je běžné použití železa
- Železo se používá při výrobě různých druhů oceli legováním s jinými prvky, například uhlíkem, niklem, chromem a wolframem k výrobě řezných zařízení, řetězů pro jízdní kola, hlavní pušek, převodových věží, mostních nosníků a železobetonu .
- Nerezová ocel obsahující vysoký podíl železa spolu s dalšími kovy má obrovskou pevnost a lepší funkci, která je užitečná při výrobě chirurgických nástrojů, kancelářských sponek, příborů, kuličkových ložisek a šperků .
- Další forma Fe zvaná kované železo získaná tavením se používá k výrobě tesařského nářadí, zvedacích háků, řetězů, plotů a bran .
- Železné náplně jsou použitelné ve vědeckých experimentech s elektromagnetismem k posouzení síly magnetů a také v metalurgii, uměleckých dílech, ohňostrojích a pískování .
- Fe působí jako účinný katalyzátor je některých průmyslových chemických procesů, jako je Haberův proces a Fischer-Tropsch .

Železná tyč
Má prvek nějaké toxické účinky
Náhodné požití Fe bylo spojeno se zvracením, průjmem a dalšími gastrointestinálními problémy, což je běžný typ otravy kovem. Dlouhodobé hromadění v těle by mohlo vést k dýchacím potížím a srdečním poruchám . Vdechování kovového prachu nebo výparů může způsobit těžkou plicní reakci .
Zajímavá fakta
- Předpokládá se, že meteority mají vysoký obsah železa .
- Železo používali starověcí navigátoři jako magnetický kov ve formě kamenů pro výrobu kompasů .
- V průměrném lidském těle jsou přítomny 4 gramy Fe, spojené s hemoglobinem, který zase pomáhá při přenosu kyslíku do plic .
-

Železný prášek
Cena železného kovu
Cena čistého železa se může pohybovat mezi 0,24 a 0,30 dolaru za libru.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Napsat komentář