Ben Valsler
Vše, co se třpytí, není zlato,
často jste to slyšeli říkat.
Brian Clegg ukazuje druhou stranu,
na bláznivé zlato – sulfid železa.
Brian Clegg
‚There’s gold in them thar hills!‘ Nebo snad ano? Jak napovídá přezdívka zlato bláznů, pyritová forma minerálu disulfidu železa II se drahému kovu podobá více než jen okrajově. S jednoduchým vzorcem FeS2 může kubická struktura sloučeniny vést k výrobě pozoruhodně efektně vypadajících platonických tvarů jak ostře ohraničených krychlí, tak dodekaedrů, které vypadají, jako by byly vyrobeny, ačkoli častěji je výsledkem přirozeného vzniku méně zřetelně ohraničená struktura.

Zdroj: ©
V krystalech disulfidu železa se atomy síry vyskytují v párech, přičemž jedna ze čtyř vazeb síry je spojena s jiným atomem síry. Tyto vazby se při zahřívání přeruší a vznikne sulfid železnatý II – FeS – a síra. Tento proces se používá při výrobě oxidu siřičitého, a to jak k použití plynu, například jako bělidla pro papír, tak jako první krok k výrobě kyseliny sírové. V poslední době našla tato sloučenina, která je polovodičem, uplatnění v lithium-železných bateriích, kde je katoda tvořena disulfidem železa: tyto baterie jsou napěťově kompatibilní s tradičními 1,5voltovými články, ale vydrží podstatně déle než alkalické ekvivalenty.

Zdroj: ©
Snad nejstarší použití disulfidu železa bylo jako alternativa křemene při jiskření – odtud název pyrit – a často se takto používal v raných pistolích. Dlouho se také používal při výrobě síranu železitého, tradičně známého jako zelený vitriol. Disulfid železa se tímto způsobem stále ještě někdy používá, i když s důmyslnějšími mechanismy, než je tradiční přístup spočívající v ponechání hromádky pyritu na dešti a sběru kapaliny, která z něj odkapává.
Při oxidaci minerálu se uvolňuje značné množství tepla, což může mít za následek výbuchy v uhelných dolech s vysokým obsahem síry. Tato tendence k oxidaci však neznamená, že disulfid železa II je vždy uzavřen. Leštěný pyrit se ve šperkařství používal od starověku a jeho poměrně tmavé krystaly (málokdy mají lesk zlata) byly obzvlášť módní od konce 17. století do začátku 20. století.

Zdroj: ©
Markazitová brož
Zmateně se šperky z pyritu nazývají markazitové šperky – matoucí proto, že existuje alternativní minerál disulfid železa II zvaný markazit, kde je kubická struktura protažena do tzv. ortorhombické formy. Tato forma je pro výrobu drahých kamenů méně vhodná, protože je křehčí a pravděpodobně se rozpadá. Název šperku (ve Velké Británii se často vyslovuje „marca-seet“) pochází z doby, kdy byly všechny formy minerálu známy jako markazit.

Zdroj: ©
Merinál markazit
Disulfid železa II však není zdaleka jediným způsobem, jak kombinovat železo a síru. Daleko méně atraktivně vypadající sulfid železa II je černě skvrnitá látka s oktaedrickou strukturou kolem železa. Tato sloučenina poměrně často vzniká rozkladem organického materiálu, ať už jako černé bahno v bažinách nebo tmavé zbarvení převařeného vaječného žloutku.
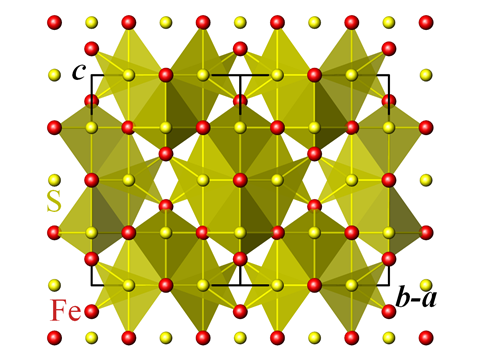
Zdroj: Perditax
Krystalová struktura greigitu
To je jen začátek pro jemné varianty sulfidu železa. Minerály známé jako greigit, mackinawit a pyrhotin mají varianty struktury, zatímco černý prášek sulfidu železa III – Fe2S3 – byl vždy vyráběn pouze uměle. Greigit se vyznačuje schopnostmi skupiny mořských bakterií objevených teprve v roce 1975, které mají pozoruhodnou schopnost orientovat se podle magnetického pole Země. Tyto organismy, nazývané „magnetotaktické“ bakterie, mají ve svých buňkách krystaly tvořené převážně greigitem, což je ekvivalent sulfidu železa nejznámějšího přirozeně se vyskytujícího magnetického materiálu, oxidu železa magnetitu.

Zdroj: Raymond T. Downward, NASA
Rytý povrch meteoritu Mundrabilla, na kterém je vidět kovová fáze slitiny železa a niklu kamcitu (38 % Ni) a taenitu (6 % Ni) vpravo dole, vlevo dole a vlevo nahoře. Tmavší materiál je sulfid železa (FeS nebo troilit) s paralelní precipitací duabreelitu (sulfid železa a chromu (FeCr2S4).
Možná nejzajímavější z alternativních struktur je troilit, další forma sulfidu železa s hexagonální strukturou. Ten se sice občas vyskytuje i na Zemi, ale nejčastěji se objevuje v meteoritech – konkrétně v poměrně neobvyklých odrůdách, které vznikly na Měsíci a Marsu, než byly při dopadu z vesmíru vyvrženy z povrchu.

Název troilit byl dán na počest italského kněze Domenica Troiliho, který v roce 1766 provedl první zaznamenané pozorování meteoru, jehož výsledkem byl dopad tělesa na zem. Troili se domníval, že hlavním materiálem meteoritu je markazit (pravděpodobně myšlen pyrit), ale téměř o 100 let později německý mineralog Gustav Rose identifikoval složení meteoritu jako jiný sulfid železa a pojmenoval ho po Troilim.
Sulfid železa může být nepříjemný. Může se hromadit například v ropných a plynových vrtech a zplstnatět potrubí. Jinde se však osvědčil. Je to sice jednoduchá sloučenina dvou jednoduchých chemických prvků a jako pyrit klamavá napodobenina zlata, ale ve svých rozmanitých formách vykazuje rozmanitost a přizpůsobivost, která z jeho uživatelů dělá cokoli, jen ne hlupáky.
Ben Valsler
To byl Brian Clegg na obranu sulfidu železa. Příští týden Mike Freemantle s petrolejem a netradiční formou boje.
Michael Freemantle
Přibližně měsíc po japonském útoku na Pearl Harbor v prosinci 1941 přišel americký zubař s plánem, jak demolovat japonská města připevněním malých zápalných bomb na netopýry.
Ben Valsler
Příště se dozvíte, jak to dopadlo v projektu Rentgen. Do té doby můžete napsat na [email protected] nebo tweetnout na @chemistryworld, pokud máte nějaké požadavky na sloučeniny, které bychom měli zařadit do podcastu. Jsem Ben Valsler, děkuji, že jste se ke mně připojili
.
Napsat komentář