Proč je v reakci s amoniakem voda kyselinou?
Jedná se o skvělou reakci z obecné chemie s důležitými důsledky pro organickou chemii. Další podobnou otázkou je, proč je voda při reakci s „kyselinou“ zásadou? Odpověď na obě otázky zní: vše je relativní! Zde na StudyOrgo často dostáváme podobné otázky týkající se témat organické chemie, která jsou obvykle rychle probrána, špatně popsána nebo se očekává, že je znáte z předchozích kurzů. Tyto pojmy jsou opravdu důležité pro pochopení složitějších témat, která přijdou na řadu. S členstvím na StudyOrgo získáte ještě více tipů a triků k tématům organické chemie a podrobné mechanismy s vysvětlením. Dnešní blog je náhledem na podrobná témata a materiály, které jsou k dispozici. Podívejte se na členství na StudyOrgo.com a zaregistrujte se ještě dnes!“
Pamatujte si, že pokud jde o kyseliny a zásady, existují dvě definice; Bronstedova a Lewisova definice. Bronstedovy kyseliny jsou definovány jako donory protonů, zatímco Lewisovy kyseliny jsou definovány jako akceptory elektronů. Obě jsou to kyseliny, ale to, co si představujeme jinak, je, zda se jedná o protony nebo elektrony. Ve vodném roztoku, obecné chemii nebo biochemii uvažujeme především o Bronstedově definici, protože disociace protonů z kyselin mění koncentraci H+ v roztoku, což interpretujeme jako změnu pH a „kyselosti“ roztoku. Disociaci protonů z kyselin neboli přijímání protonů zásadami měříme číselnou hodnotou, kterou je pKa. Čím je pKa větší, tím je kyselina slabší a zásada silnější. Čím je pKa nižší, tím je kyselina silnější a zásada slabší. Jednoduchý trik pro přemýšlení o pKa spočívá v tom, že protonovanou verzi molekuly umístíte vlevo a budete ji považovat za donor protonu. PKa vám říká, jak snadná bude tato donace, čím nižší číslo, tím snazší bude donace protonu.
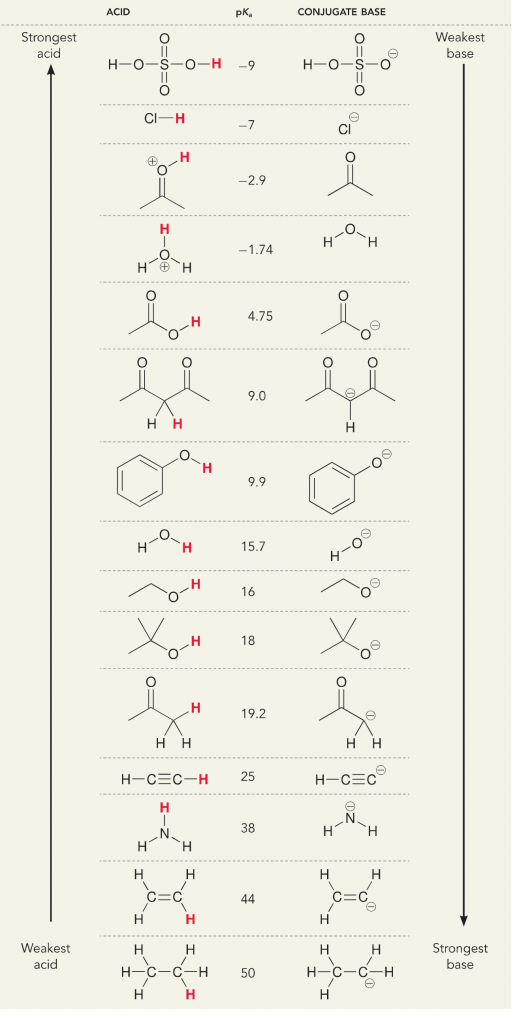
Podívejme se na reakci amoniaku a vody; pKa pro vodu je definována jako 14. V tomto případě je pKa nižší než pKa. PKa pro amoniak je ~37.
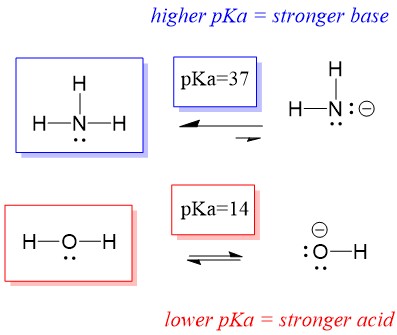
Protože je tedy pKa vody nižší než pKa amoniaku, je silnější kyselinou amoniak a bude darovat protony amoniakové bázi. Tato reakce vede k tomu, že se voda stane konjugovanou zásadou OH- a amoniak konjugovanou kyselinou NH4+. Zajímavé je, že právě proto je amoniak žíravinou, protože vytváří hydroxid, který reaguje se skvrnami a mikroorganismy a účinně čistí a dezinfikuje předměty v domácnosti.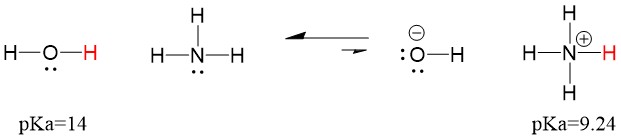
Toto je důležité jako koncept organické chemie, protože síla kyselin a zásad z hlediska elektronů neboli Lewisova definice je přesně to, jak přemýšlíme o mechanismech porušování a vytváření vazeb; o toku elektronů. Síla Lewisových kyselin a konjugovaných kyselin může pomoci určit, kterým směrem bude reakce probíhat. Vidíme, že reakce voda an amoniak je nepříznivá, ale ve skutečnosti dochází k dostatečnému množství reakcí, aby se výrazně snížilo pH vody (pH~11 s amoniakem).
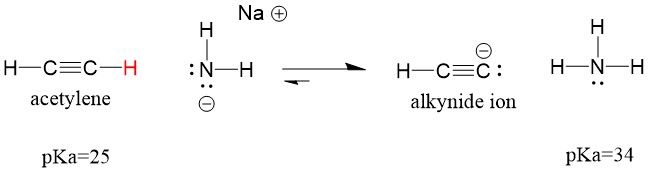
Podívejme se na acetylen reagující se zásadou za vzniku alkynidového iontu, užitečného nukleofilu pro tvorbu C-C vazby. Pokud se pokusíme o reakci hydroxidu sodného s alkynem, alkynidový ion NEBUDE vznikat. Je to proto, že konjugovaný kyselý produkt reakce – voda, která má pKa 15, je SILNĚJŠÍ než původní kyselý acetylen (pKa = 25). Reakce VŽDY upřednostňují vznik slabší kyseliny, nebo v tomto případě reakční strany.
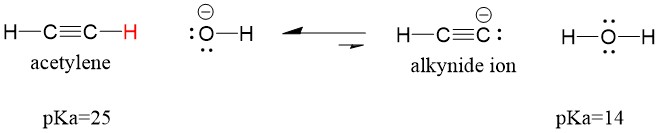
Pokud změníme naši bázi na amid sodný, který je mnohem silnější bází, alkynidový ion vznikne. Je to proto, že konjugovaným kyselým produktem reakce je amoniak, který má pKa 38 a je slabší konjugovanou kyselinou než původní kyselina acetylenová (pKa = 25). V tomto případě je reakce ve prospěch strany produktu!
 .
.
Napsat komentář