Dipól – dipólové síly
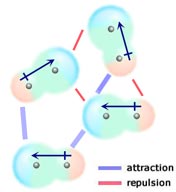
Přiblíží-li se dvě neutrální molekuly, z nichž každá má trvalý dipólový moment, tak, že se jejich opačně nabité konce vyrovnají, budou se vzájemně přitahovat. V kapalině nebo pevné látce mají tato uspořádání přednost před těmi, kde jsou stejně nabité konce molekul blízko sebe, a proto se odpuzují.
Jedním z důvodů, proč má CH3F vyšší teplotu varu (-84 °C) než CF4 (-128 °C), je to, že CF3H má stálý dipólový moment, zatímco CF4 nikoli. K plnému pochopení této skutečnosti je třeba vědět, že CF4 má tetraedrický tvar a CH3F má zhruba tetraedrický tvar (ve tvarech těchto molekul není velký rozdíl). Vazby uhlík – fluor v obou molekulách jsou polární (fluor je mnohem elektronegativnější než uhlík), avšak přítomnost čtyř vazeb C-F v tetraedrické molekule CF4 činí molekulu celkově nepolární. Dipólový moment jediné vazby C-F v CH3F není vyrušen dipóly vazby C-H (které jsou velmi malé), takže CH3F má trvalý dipólový moment.
Typem mezimolekulární síly, která může vznikat za určitých okolností a obvykle se klasifikuje jako dipólově-dipólová interakce, i když má určitý kovalentní vazebný charakter, je vodíková vazba.
Napsat komentář