Z Proteopedie
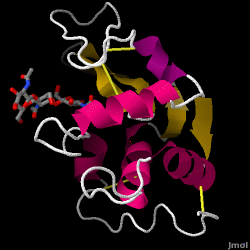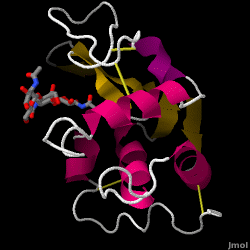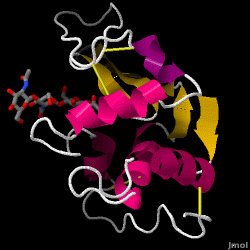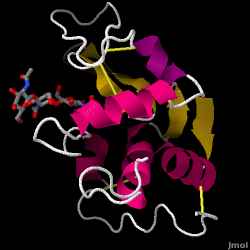
Lysozym – známý také jako muramidáza – je silný enzym, který se hojně vyskytuje v slzách, slinách a lidském mléce. U lidí je kódován v genu LYZ. Jelikož se jedná o malý, snadno dostupný a vysoce stabilní protein, byl předmětem rozsáhlého výzkumu týkajícího se jeho funkce a struktury.
Úvod
Lysozym působí jako nespecifická obrana proti bakteriím a plísním. Je součástí vrozeného imunitního systému a je důležitou součástí kojenecké stravy k odvrácení průjmu. Je to enzym známý svou schopností rozkládat polysacharidovou architekturu mnoha druhů buněčných stěn, obvykle za účelem ochrany před bakteriální infekcí. Struktura lysozymu ze slepičího bílku (HEW), který je předmětem tohoto článku, je znázorněna vpravo. Antibakteriální aktivitu slepičího vaječného bílku poprvé popsal Laschtschenko v roce 1909. Charakterizoval jej a pojmenoval „lysozym“ Alexander Fleming, stejná osoba, která se zasloužila o objev penicilinu. K objevu enzymatické aktivity došlo náhodou; během nesouvisejícího pokusu se nosní kapénky nedopatřením dostaly do Petriho misky obsahující bakteriální kulturu, která následně vykazovala výsledky dosud neznámé enzymatické reakce. Pozorování této neznámé reakce vedlo k dalšímu výzkumu složek této reakce a také k odpovídající identifikaci nově objeveného „lysozymu“. V roce 1965 David C. Phillips a jeho spolupracovníci určili trojrozměrnou strukturu lysozymu s rozlišením 2 Å . Phillipsova práce byla přelomová zejména proto, že se mu podařilo úspěšně objasnit strukturu enzymu pomocí rentgenové krystalografie, což se dosud nikomu nepodařilo. Phillipsův výzkum také vedl k hypotéze mechanismu jeho účinku založené na struktuře.
Funkce
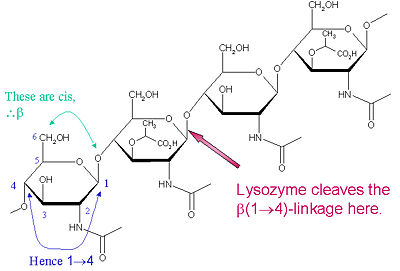
Konkrétním substrátem preferovaným pro tento typ štěpení je (NAG-NAM)₃ hexasacharid, v jehož substrátu se vyskytujecílová glykosidická vazba, NAM₄-β-O-NAG₅. Jednotlivé vazebné jednotky hexasacharidu jsou označeny A-F, přičemž preference štěpení glykosidové vazby NAM₄-β-O-NAG₅ odpovídá jednotce D-E glykosidové vazby cl
Lysozym je známý tím, že poškozuje bakteriální buněčné stěny katalýzou hydrolýzy 1,4-beta-vazby mezi N-acetylmuraminovými (NAM) a N-acetyl-D-glukosaminovými (NAG) zbytky v peptidoglykanu a mezi N-acetyl-D-glukosaminovými zbytky v chitodextrinu. Tímto způsobem lysozym účinně lyzuje buněčné stěny bakterií i hub. Místem štěpení lysozymu v tomto architektonickém motivu je β(1-4) glykosidická vazba spojující C1 uhlík NAM s C4 uhlíkem NAG.
Konkrétním substrátem preferovaným pro tento typ štěpení je (NAG-NAM)₃ hexasacharid, v jehož substrátu se vyskytujecílová glykosidická vazba, NAM₄-β-O-NAG₅. Jednotlivé vazebné jednotky hexasacharidu jsou označeny A-F, přičemž preference štěpení glykosidové vazby NAM₄-β-O-NAG₅ odpovídá preferenci štěpení glykosidové vazby jednotky D-E. V závislosti na organismu, ze kterého je lysozym získán, probíhá hydrolýza glykosidické vazby se zachováním konfigurace na anomerním uhlíku (slepičí vaječný bílek) nebo s inverzí (husa, fág T4).
Lysozym účinně působí na dlouhé (NAG-NAM) nebo (NAG) polymery. S délkou řetězce menší než šest monomerů katalytická rychlost podstatně klesá; trisacharidy totiž působí jako kompetitivní inhibitory tím, že se vážou do aktivního místa v neproduktivním registru.
Hen egg white lysozyme (PDB kód 1hew)
Mechanismus
Hydrolyzace glykosidických vazeb lysozymem slepičího vaječného bílku probíhá se zachováním konfigurace. V roce 1953 Koshland navrhl, že obecně zachování konfigurace znamená mechanismus dvojího posunu (zatímco inverze konfigurace znamená jednoduchý posun). Po desetiletí byly zvažovány dvě konkurenční mechanistické hypotézy (Phillips: disociativní mechanismus s oxokarbenovým meziproduktem; Koshland: dvoustupňový asociativní mechanismus s kovalentním enzymovým komplexem jako meziproduktem), přičemž údaje z roku 2001 převážily misku vah na stranu existence kovalentního meziproduktu. Absence struktury substrátového komplexu jistě přispěla k obtížím při rozlišování možných mechanismů, stejně jako existence dvou odlišných mechanismů (retence a inverze konfigurace) v rámci stejné strukturní rodiny enzymů (např. enzym slepice vs. enzym husa).
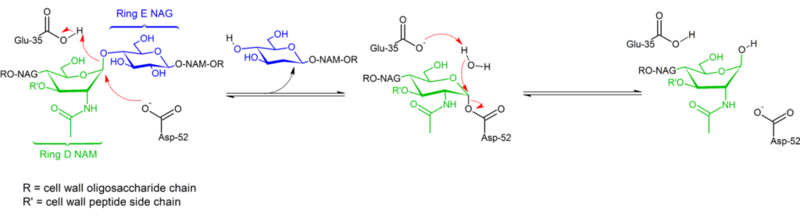
Lysozym hydrolyzuje glykosid (odtud familiární klasifikace lysozymu jako glykosylázy), což odpovídá přeměně acetalu na hemiacetal. Reakce probíhá ve dvou krocích, jak je znázorněno na obrázku výše. V prvním kroku působí Asp 52 jako nukleofil a část cukru je odcházející skupinou. Ve druhém kroku působí voda jako nukleofil a Asp 52 jako odcházející skupina. Oba kroky invertují konfiguraci na anomerním uhlíku, což vede k celkovému zachování konfigurace. Glu 35 působí v prvním kroku jako kyselina (protonizuje cukr v glykosidické vazbě, aby se stal lepším elektrofilem) a ve druhém kroku jako báze (deprotonizuje vodu, aby se stala lepším nukleofilem). Ačkoli obrázek ukazuje některé z cukrů v lodní konformaci, aby zdůraznil inverzi konfigurace, tyto cukry nejsou experimentálně pozorovány, ale spíše se nacházejí v křeslové konformaci.
Použití lysozymu
Protože lysozym je široce známý pro své antibakteriální a antimykotické vlastnosti, má širokou škálu použití jak v biochemii, tak ve farmacii. V molekulární biologii se lysozym často používá v postupu alkalické lýzy pro extrakci a izolaci plasmidové DNA. Ve farmaceutické oblasti se hojně používá k ničení grampozitivních bakterií a lze jej použít k podpoře již existující imunitní obrany v boji proti bakteriálním infekcím. Tento enzym je zvláště důležitý pro prevenci bakteriálních onemocnění u kojenců. Díky svým antibakteriálním vlastnostem může být lysozym používán také v potravinářském průmyslu k prevenci kažení potravin.
Viz také
- Lysozym 3D struktury
- Lysozym
- Zadržování glykosidových hydrolas
- Molekulární hřiště/Lysozym
- Uživatel:Judy Voet/Lysozyme
- Lysozyme (Arabic)
- Lysozyme (hebrew)
- Ragland SA, Criss AK. Od zabíjení bakterií k imunitní modulaci: Nejnovější poznatky o funkcích lysozymu. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure of hen egg-white lysozyme (Struktura lysozymu slepičího bílku). A three-dimensional Fourier synthesis at 2 Angstrom resolution. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. An Introduction to Enzyme and Coenzyme Chemistry [Úvod do chemie enzymů a koenzymů]. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Krystalografické studie aktivity lysozymu slepičího vaječného bílku. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Obrázek z: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Rané páskové kresby proteinů. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure of hen egg-white lysozyme [Struktura lysozymu slepičího bílku]. A three-dimensional Fourier synthesis at 2 Angstrom resolution. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Struktura některých krystalických komplexů lysozymu a inhibitoru určená rentgenovou analýzou při 6angstromovém rozlišení. Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers a Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia Page Contributors and Editors (what is this?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
.
Napsat komentář