V tomto tutoriálu je krok za krokem nakreslena Lewisova struktura uhličitanového iontu. Pro nakreslení Lewisovy struktury iontu CO32- je použit koncept celkových valenčních elektronů. Po dokončení lewisovy struktury CO32- by měl být náboj -2 a stabilita. O těchto věcech se dozvíte v tomto výukovém programu.
- Uhličitanový iont | CO32-
- Lewisova struktura CO32-
- Kroky kreslení Lewisovy struktury CO32-
- Celkový počet elektronů valenčních slupek CO32-
- Celkový počet valenčních elektronových párů
- Centrální atom iontu CO32-
- Samostatné páry na atomech
- Náboje na atomech
- Zkontrolujte stabilitu a minimalizujte náboje na atomech převedením osamělých párů na vazby
- Lewisova struktura iontu CO32- (uhličitanového)
- uhličitanové lewisovy struktury a hydrogenuhličitanové lewisovy struktury
Uhličitanový iont | CO32-
Uhličitanový iont má náboj -2 . Sloučeniny uhličitanů kovů jsou ve světě běžné. Jako příklad lze uvést CaCO3.
Lewisova struktura CO32-
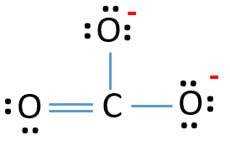
V Lewisově struktuře iontu CO32- jsou tři vazby σ a vazba π kolem atomu uhlíku.
Kroky kreslení Lewisovy struktury CO32-
Kreslení Lewisovy struktury CO32- vyžaduje následující kroky, které jsou podrobně vysvětleny v tomto učebním materiálu.
- Zjistěte celkový počet elektronů valenčních slupek atomů uhlíku a kyslíku
- Celkový počet elektronových párů
- Výběr centrálního atomu
- Přidejte osamělé páry na atomy
- Zkontrolujte stabilitu a minimalizujte náboje na atomech převedením osamělých párů na vazby.
Nakreslení správné Lewisovy struktury je důležité pro správné nakreslení rezonančních struktur CO32-.
Celkový počet elektronů valenčních slupek CO32-
Uhlík se nachází ve 4. skupině periodické tabulky. Uhlík má tedy ve své valenční slupce čtyři elektrony. kyslík se nachází v 6. skupině. Ve valenční slupce má šest elektronů.
- Celkový počet valenčních elektronů daných atomem uhlíku = 4
V iontu CO32- jsou tři atomy kyslíku, proto
- Celkový počet valenčních elektronů daných atomy kyslíku = 6 *3 = 18
Na iontu CO32- je -2 náboj. Proto jsou zde další dva elektrony, které přispívají k valenčním elektronům.
- Celkový počet valenčních elektronů = 4 + 18 + 2 = 24
Celkový počet valenčních elektronových párů
Celkový počet valenčních elektronových párů = σ vazby + π vazby + osamělé páry na valenčních slupkách
Celkový počet elektronových párů určíme vydělením počtu celkových valenčních elektronů dvěma. Pro iont CO32- je celkový počet elektronových párů 12.
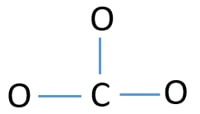
Centrální atom iontu CO32-
Pro to, aby byl centrální atom, je důležitá schopnost mít vyšší valenci. Uhlík má větší šanci být středovým atomem (viz obrázek), protože uhlík může vykazovat valenci 4. Nejvyšší valence kyslíku je 2. Nyní tedy můžeme sestavit náčrtek iontu CO32-.
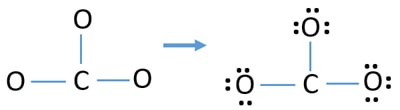
Samostatné páry na atomech
- Ve výše uvedeném náčrtu jsou již tři vazby C-O. Vazby C-O se nacházejí na atomu CO32-. Zbývá tedy pouze devět (12-3 = 9) párů valenčních elektronů.
- Nejprve označte těchto devět párů valenčních elektronů jako osamělé páry na vnějších atomech (na atomech kyslíku). Jeden atom kyslíku přijme tři osamělé páry podle osmičkového pravidla (atom kyslíku si ve své valenční slupce nemůže ponechat více než osm elektronů).
- Na tři atomy kyslíku zbývá devět elektronových párů. Nyní po označení atomů kyslíku (mimo atomy) již není na atomech uhlíku žádný osamělý pár k označení.
Náboje na atomech
Po označení elektronových párů na atomech bychom měli označit náboje jednotlivých atomů. Označení nábojů je významné, protože slouží k určení nejlepší Lewisovy struktury iontu. Po označení nábojů uvidíte, že každý atom kyslíku dostane náboj -1 a atom uhlíku dostane náboj +1.
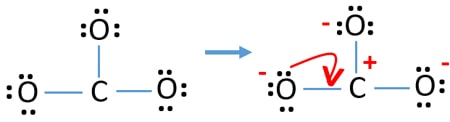
Zkontrolujte stabilitu a minimalizujte náboje na atomech převedením osamělých párů na vazby
- Atomy kyslíku by měly mít záporné náboje, protože elektronegativita atomu kyslíku je vyšší než atomu uhlíku. Jinak můžeme říci, že schopnost držet záporné náboje je u atomů kyslíku větší než u atomů uhlíku.
- Nakreslená struktura není stabilní, protože všechny atomy mají náboj (Lewisova struktura by měla být stabilní s menším počtem nábojů).
- Nyní bychom se měli pokusit minimalizovat náboje přeměnou osamělého páru nebo párů na vazby. Převeďte tedy jeden osamělý pár jednoho atomu kyslíku na vazbu C-O.
- Nyní vznikne dvojná vazba mezi atomem uhlíku a jedním atomem kyslíku (jedna vazba C=O). Nyní jsou mezi atomem uhlíku a dalšími dvěma atomy kyslíku dvě jednoduché vazby (dvě vazby C-O).
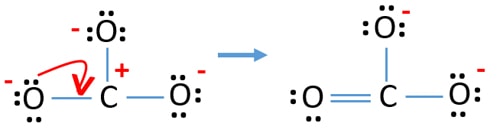
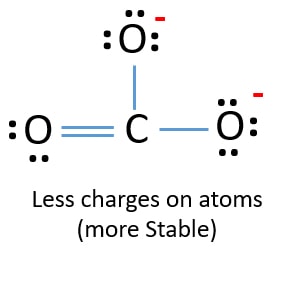
V nové struktuře jsou náboje atomů sníženy oproti předchozí struktuře. Nyní nejsou žádné náboje na jednom atomu kyslíku a atomu uhlíku. Také pouze dva atomy kyslíku mají -1 záporný náboj. Nyní chápete, že tato struktura CO32- je stabilnější než předchozí struktura. Tato struktura má tedy větší šanci stát se Lewisovou strukturou iontu CO32-.
Lewisova struktura iontu CO32- (uhličitanového)
Otázky
Pokládej otázky z chemie a najdi odpovědi
uhličitanové lewisovy struktury a hydrogenuhličitanové lewisovy struktury
V uhličitanovém iontu jsou dva atomy kyslíku, které mají na každém z nich -1 náboj. Jeden z těchto atomů kyslíku přijme proton (iont H+) a vytvoří skupinu -OH.
Související výukové materiály
.
Napsat komentář