Klíčová slova
CADASIL – cévní mozková příhoda – MRI
Úvod
Cerebrální autozomálně dominantní arteriopatie se subkortikálními infarkty a leukoencefalopatií (CADASIL) je dědičné onemocnění malých tepen způsobené různými patogenetickými mutacemi NOTCH-3 genu. Je charakterizována spojením migrény s aurou, psychiatrickými příznaky, opakovanými ischemickými příhodami v raném věku a kognitivními poruchami. Právě tyto a pro ni typické radiologické nálezy nám obvykle pomáhají vyslovit podezření na toto onemocnění. Obvykle se považuje za onemocnění mladých a dospělých středního věku, ale případy u starších osob mohou být poddiagnostikovány. Uvádíme případ muže, u kterého byl CADASIL diagnostikován v jeho pozdních sedmdesáti letech díky předchozí diagnóze jeho dcery.
Případy
Případ 1
Dceři našeho pacienta bylo 50 let, když byla z neurologické ambulance odeslána do naší nemocnice k dalšímu vyšetření kvůli radiologickému nálezu na magnetické rezonanci mozku, který spočíval ve změnách bílé hmoty v obou zevních pouzdrech, oboustranných periventrikulárních oblastech a levém temporálním laloku.
Došla na výše uvedenou kliniku, protože již 30 let trpěla migrénou se zrakovou aurou, přičemž některé epizody naznačovaly zrakovou auru bez bolesti hlavy. Žádné jiné příznaky neměla. Byla alergická na fosfomycin a v dětství podstoupila tonzilektomii. V minulosti neměla žádnou jinou anamnézu. Její rodinná anamnéza byla pozoruhodná: matka trpěla migrénou a mírnou demencí a otec prodělal ve věku 75 let cévní mozkovou příhodu; dědeček, strýc a teta z otcovy strany prodělali cévní mozkovou příhodu a strýci byla diagnostikována Alzheimerova choroba, bratranec z otcovy strany dostal jinde diagnózu „ANA+ vaskulitida“ a dalšímu bratranci z otcovy strany byla diagnostikována roztroušená skleróza. Měla dva zdravé syny. Fyzikální vyšetření, včetně pečlivého neurologického vyšetření, bylo zcela normální. Opakované vyšetření mozku magnetickou rezonancí ukázalo mnohočetné hyperintenzní léze v bílé hmotě zadního výběžku, periventrikulárních a subkortikálních oblastech, včetně předních temporálních laloků, zejména levého, obou center semiovale, vnitřní a zevní kapsuly, bez známek nedávných nebo minulých mikrokrvácení (obr. 1). Všechna ostatní vyšetření, včetně hemogramu, glykémie, jaterních a renálních funkcí, rychlosti sedimentace erytrocytů, sérových hormonů štítné žlázy, screeningu hyperkoagulace, screeningu vaskulitidy, EKG, rentgenu hrudníku, sérologie syfilis a HIV a ultrasonografie supraaortálních kmenů s dopplerem, byla normální s výjimkou cholesterolemie 220 mg/dl s LDL cholesterolem 152 mg/dl. Kožní biopsie byla rovněž normální. Ve čtvrtém exonu genu NOTCH 3 byla zjištěna mutace Arg169Cys (záměna cytosinu za tymin v kodonu 505), která je známá jako patogenetická, a proto jí byla diagnostikována nemoc CADASIL. S touto diagnózou byli oba rodiče vyšetřeni na naší klinice.
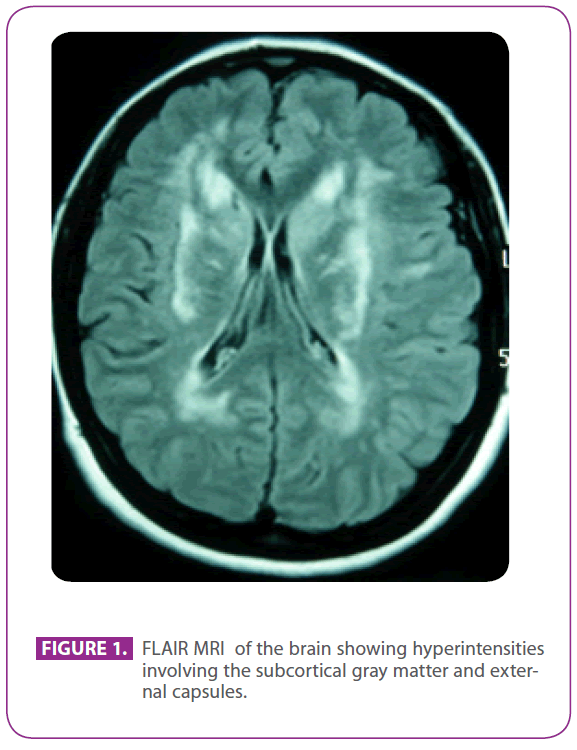
Obrázek 1: MRI mozku FLAIR zobrazující hyperintenzity zahrnující subkortikální šedou hmotu a zevní pouzdra.
Případ 2
Její matce bylo 78 let. Dlouhodobě trpěla migrénou bez aury a v posledních dvou letech se u ní rozvinula mírná demence se symetrickým parkinsonismem, fluktuacemi a poruchou chování ve spánku REM, což nasvědčuje demenci s Lewyho tělísky. Magnetická rezonance mozku vyloučila relevantní onemocnění bílé hmoty.
Její otec byl 79letý muž s několika vaskulárními rizikovými faktory: diabetes mellitus 2. typu, dyslipidémií a 50letým kouřením s kumulativním indexem 15 krabičkových let, ačkoli před 3 lety přestal kouřit. V roce 1991 prodělal ischemickou chorobu srdeční s posteroinferiorním infarktem myokardu. V posledních 8 letech prodělal tři tranzitorní ischemické příhody a lakunární cévní mozkovou příhodu odpovídající různým arteriálním teritoriím s progresivním postižením chůze a v posledních 6 měsících byl poněkud uzavřený a apatický. Migrénu v anamnéze neměl. Užíval metformin, klopidogrel, atenolol a atorvastatin. Při fyzikálním vyšetření byl při vědomí a orientovaný, ale poněkud nepozorný, řeč a vzdálená i recentní paměť byly normální, vykazoval ideomotorickou apraxii, změněnou podobnost a interpretaci rčení, bez frontálních uvolňovacích reflexů. Vykazoval také globální hyperreflexii s oboustrannými flexorovými plantárními reflexy a chůzi s krátkými kroky a sníženými pohyby paží. CT vyšetření provedené před dvěma lety, po jedné z tranzitorních ischemických atak , ukázalo rozsáhlé postižení bílé hmoty, zvláště nápadné v zevním pouzdře a temporálních lalocích (obr. 2).
Shrnem lze říci, že pacient měl opakované ischemické příhody, mírnou subkortikální kognitivní poruchu a leukoencefalopatii, vysoce suspektní z diagnózy CADASIL vzhledem k diagnóze jeho dcery. Bylo provedeno genetické vyšetření, které prokázalo stejnou mutaci NOTCH 3 jako u dcery a potvrdilo diagnózu.
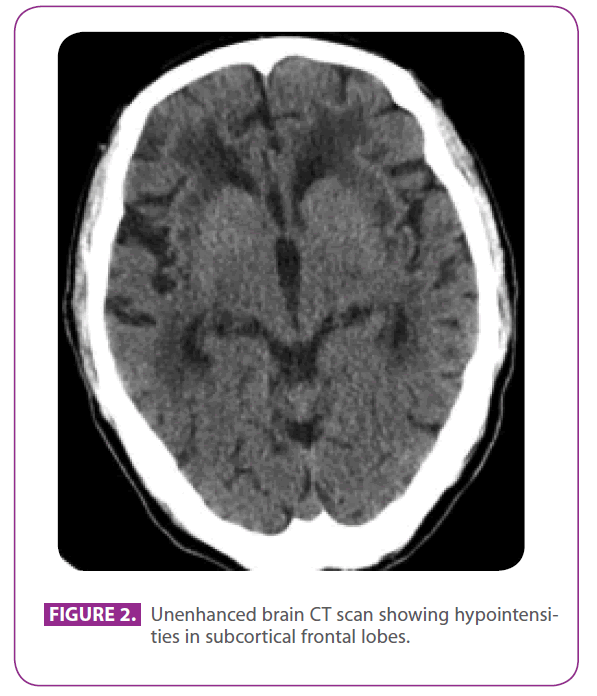
Obrázek 2: Nevyšetřené CT mozku ukazující hypointenzity v subkortikálních frontálních lalocích.
Diskuse
CADASIL je nejčastější dědičné onemocnění malých cév. Může se však vyskytovat i sporadicky, neboť byly popsány de novo mutace. Je způsobena různými patogenními mutacemi v genu NOTCH-3, který se nachází na chromozomu 19, lokus 19p13.2-p13.1, a skládá se z 33 exonů, které kódují protein o velikosti 2321 aminokyselin (1). Tento protein je jednoprůchodový transmembránový receptor na povrchu buněk exprimovaný v buňkách hladkého svalstva systémových arterií, s extracelulární regulační doménou a intracelulární transduktorovou doménou. Dosud bylo zaznamenáno více než 190 mutací, které mohou vést ke vzniku CADASIL, a všechny se vyskytují v exonech 2 až 24 genu NOTCH 3, které kódují 34 epidermálnímu růstovému faktoru podobných repetic extracelulární části NOTCH 3. Screening těchto 23 exonů má proto 100% citlivost a téměř stejnou specifitu (2). Z těchto mutací je více než 180 missense mutací, nejméně 6 delecí, jedna inzerce, jeden frameshift a 2 duplikace. Většina patogenních mutací NOTCH3 se vyskytuje v exonech 3 a 4 (3).
Všechny mutace mají za následek přidání nebo ztrátu cysteinového zbytku v opakování podobném EGF, a tedy lichý počet cysteinových zbytků, což vede k tvorbě abnormálních disulfidových můstků. Mutantní NOTCH3 způsobuje degeneraci hladkých buněk cév v malých tepnách a arteriolách a hromadění abnormálního proteinu ve stěně těchto cév, což vede ke stenóze lumen (1). V mozku postihuje penetrující mozkové a leptomeningeální tepny, vyvolává neschopnost autoregulace těchto cév a hypoperfuzi jimi zavodněných teritorií, a tedy infarkty v bílé hmotě.
Prvním příznakem CADASIL, pokud se projeví, je obvykle migréna s aurou, s průměrným věkem nástupu 30 let. Objevuje se u 20 až 40 % pacientů (4). Většina záchvatů je typická se zrakovou nebo senzorickou aurou, ale polovina pacientů má i atypické záchvaty s bazilární, hemiplegickou nebo prodlouženou aurou.
Subkortikální ischemické příhody, přechodné záchvaty nebo cévní mozkové příhody, se objevují u 60 až 85 % pacientů, první v průměrném věku 50 let, i když se mohou objevit již ve druhé dekádě. Většinou nejsou přítomny žádné konvenční cévní rizikové faktory nebo nejsou příliš významné. U dvou třetin pacientů se ischemické příhody klinicky a radiologicky projevují jako lakunární syndromy. Většina pacientů prodělá několik cévních mozkových příhod, obvykle 2 až 5, což vede během několika let k potížím s chůzí, močové a fekální inkontinenci, demenci a pseudobulbární paralýze (1). Druhým nejčastějším klinickým projevem jsou kognitivní poruchy. Nejčasnějším příznakem je obvykle porucha exekutivních schopností a rychlosti zpracování dat, která je přítomna u většiny pacientů starších 35 let, ale může se objevit již v první dekádě života (5). Toto kognitivní postižení je progresivní a při opakovaných cévních mozkových příhodách se obvykle zhoršuje, přičemž se přidává postižení instrumentálních činností, paměti, jazyka, uvažování a vizuoprostorových schopností. Více než 70 % pacientů je dementních v šesté dekádě života. Těžká afázie, apraxie nebo agnózie jsou u CADASIL vzácné.
Psychiatrické poruchy, především poruchy nálady, se objevují u 20 % pacientů, většinou jako těžké depresivní epizody. Apatie je přítomna u 40 % pacientů a nesouvisí s depresí Dalšími méně častými klinickými projevy jsou akutní reverzibilní encefalopatie (6) (u 10 % pacientů), většinou se vyskytující po migréně s aurou, záchvaty (u 5 až 10 % pacientů), hluchota, parkinsonismus, mozkové krvácení (většinou u pacientů s vysokým krevním tlakem) a infarkt myokardu.
Přes svou úplnou penetranci má CADASIL významnou inter a intrafamiliární variabilitu klinických projevů. Stejná mutace NOTCH-3 má široké klinické spektrum bez jasných rozdílů mezi homozygotními a heterozygotními pacienty. Ve skutečnosti neexistuje korelace mezi genotypem a klinickým fenotypem (4). Příčina těchto rozdílů není známa, ale byly popsány některé možné modifikátory fenotypu CADASIL, jako je současné kouření pro riziko mozkové příhody a věk první mozkové příhody, vysoký krevní tlak pro riziko mozkové příhody nebo hladina homocysteinu pro věk vzniku migrény (3,4). Tyto a další faktory by mohly ovlivnit klinický projev onemocnění modifikací genové exprese nebo ovlivněním jiných fyziopatologických cest, které mohou vést ke stejným klinickým projevům.
Radiologické změny se objevují u všech jedinců s mutací CADASIL před 35. rokem života a s časem se zvyšují. Nejčasnějšími a nejčastějšími znaky jsou hyperintenzivní neenhancující bodové oblasti v bílé hmotě mozku a podkorových strukturách v T2 vážených a fluidně zeslabených inverzních recovery obrazech MRI. Postižení zevních pouzder a přední části spánkových laloků je pro toto onemocnění typické a je vodítkem pro stanovení diagnózy, protože pomáhá v diferenciální diagnostice s jinými stavy, jako je například onemocnění malých cév (1).
CADASIL je běžně považován za onemocnění mladých a dospělých středního věku, ale počet starších pacientů může být poddiagnostikován (7,8). Jako příklad může posloužit náš druhý případ: 79letý pacient s vaskulárními rizikovými faktory a opakovanými cévními mozkovými příhodami, s onemocněním bílé hmoty, které bylo několika neurology považováno za sekundární onemocnění malých cév. K diagnóze dospěl až poté, co se dozvěděl o mutaci své dcery. V případech bez jasné rodinné anamnézy , může být jediným vodítkem pro správnou diagnózu otevřená mysl a pečlivá pozornost věnovaná sugestivním radiologickým nálezům, jako je postižení zevního pouzdra nebo předních spánkových laloků.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: série případů 11 pacientů. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. Klinické spektrum CADASIL a vliv kardiovaskulárních rizikových faktorů na fenotyp: studie u 200 konsekutivně přijatých jedinců. Stroke 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. Vliv genetických a kardiovaskulárních rizikových faktorů na fenotyp CADASIL. Brain (Mozek). 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepezil u pacientů se subkortikální vaskulární kognitivní poruchou: randomizovaná dvojitě zaslepená studie u CADASIL. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. „CADASIL coma“: an underdiagnosed acute encephalopathy. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. Homozygotnost pro mutaci NOTCH3 u 65letého pacienta s CADASIL s mírnými příznaky: rodinná zpráva. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. Pozoruhodně variabilní expresivita CADASIL: zpráva o minimálně symptomatickém muži v pokročilém věku. J Neurol. 2009;256:1026-7
Napsat komentář