Co mají společného minipreparáty DNA a experimenty s imunoprecipitací proteinů? Začínají různě, ale končí stejnou, kritickou fází – elucí. Ale co přesně je eluce a jaký má smysl?
Terminologie
Nejprve začneme základní terminologií:
Eluce – extrakce jednoho materiálu z druhého promytím rozpouštědlem.
Adsorbent – pevná fáze, kterou může být silikagel v případě minipreparátových kolon, ale obvykle kuličky, které mohou být kovalentně spojeny s protilátkami nebo jinými ligandovými molekulami. „Pevná fáze“ nemusí nutně znamenat stojatou kolonu; mohou to být kuličky v eppendorfce, které se snadno promývají.
Afinita – míra schopnosti absorbentu vázat vybranou molekulu (to, co se snažíte eluovat). Čím vyšší je afinita pevné fáze k vybrané biomolekule (BOC), tím pevněji se na ni molekula váže. Nechcete však, aby vazba byla nevratná; to by znemožnilo eluci.
Eluent – rozpouštědlo, které odstraňuje BOC z absorbentu.
Eluát – rozpouštědlo obsahující BOC odstraněnou z adsorbentu.
Příprava materiálu
Před elucí je třeba absorbovat vybranou molekulu a zároveň se zbavit kontaminace. To je zásadní krok, jak nám připomíná tradiční moudrost „odpadky dovnitř, odpadky ven“. Můžete mít vynikající činidla pro eluci, ale pokud váš vzorek obsahuje příliš mnoho nepříbuzného personálu (vědecký termín je „gunk“), ucpe adsorpční materiál. Nasycení pevné fáze zabrání vašemu BOC v absorpci a následně kontaminuje eluát. Účinné kroky lýzy a čištění jsou zásadní pro úspěch vašeho elučního experimentu.
Je důležité určit objem vašeho předabsorpčního materiálu. Objem lyzátu, který projde absorpčním médiem, by neměl překročit 3 – 5 objemů kolony. Velký objem lyzátu, který prochází absorpčním prostředkem, prodlužuje dobu experimentu a také pravděpodobnost absorpce sajrajtu. V mnoha případech se vyplatí snížit počáteční objem lyzátu filtrací nebo frakcionací. Objem lyzátu tedy určuje velikost kolony.
Výběr adsorpčního materiálu závisí na chemickém složení molekuly vašeho zájmu. Absorpce biomolekul obvykle zahrnuje více či méně specifickou interakci mezi substrátem a molekulou. Například DNA se na minikolonkách absorbuje v důsledku iontové interakce mezi záporně nabitými fosfátovými skupinami DNA a kladně nabitými částicemi oxidu křemičitého.
Proteiny se obvykle adsorbují na sefaroze nebo magnetických kuličkách pokrytých IgG.
Po počáteční aplikaci lyzátu nesmí vaše kolona v žádném okamžiku vyschnout. Tím se vaše molekula „připeče“ k absorbentu a naruší se integrita kolony. Pokud nemáte čas pokračovat v experimentu, doplňte kolonu kompatibilním pufrem a zastavte průtok.
Proplachování
Účelem promytí pevné fáze je odstranit nesouvisející materiál, zatímco molekula zájmu zůstane na koloně. Selektivní separace se často dosahuje použitím pufru s nízkou iontovou silou (např. nízkou koncentrací soli). Objem promývacího pufru by se měl blížit množství výchozího materiálu a měl by činit alespoň 3-5 objemů kolony.
Po průchodu několika objemů promývacího pufru kolonou se však kontaminace odplaví a jakékoli další promývání nezlepší kvalitu vaší přípravy. Navíc začnete ztrácet cílový materiál.
Eluce
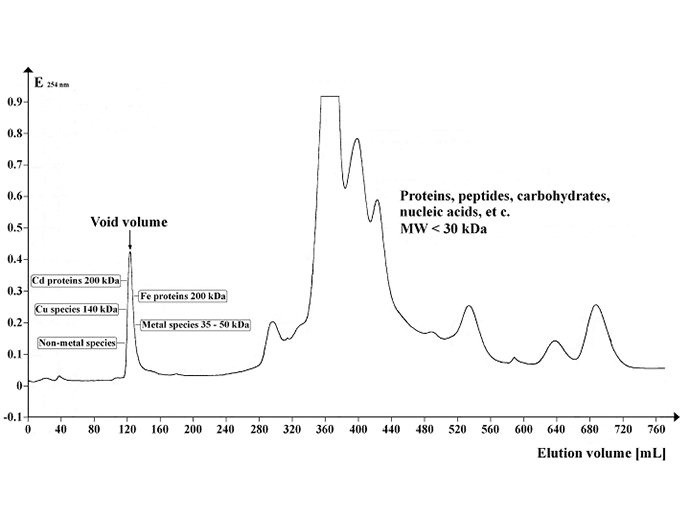
Obrázek: Chromatogram zobrazující UV absorpční profil supernatantu Arabidopsis separovaného na Sephadexu G-50 Superfine. Objem gelu: 500 ml; délka kolony: 700 mm; průměr kolony: 30 mm; průtok eluentu: 12 ml/hod; objem frakce: 8,0 ml; počet frakcí: 1: 95; objem vzorku: 5 ml; teplota separace: 4 °C; eluční pufr: 20 mM Tris-HCl, 1 mM NaN3; pH 8,0. Obrázek: https://commons.wikimedia.org/wiki/File:Chrom_SephG-50.tif
Eluce sama o sobě funguje, protože se naruší vazby mezi kolonou a substrátem (tj. použitím vysoké soli nebo vysoké teploty eluentu). Eluce se obvykle provádí v malém objemu pufru kompatibilním se skladováním vzorku a dalším použitím.
Eluce DNA z minipřípravné kolony je nejjednodušším případem: jeden objem pufru odstraní téměř veškerou DNA. Koncentrace DNA v eluátu je nepřímo úměrná použitému elučnímu pufru: čím více pufru použijete, tím menší je konečná koncentrace DNA. Nicméně i v tomto případě většina výrobců doporučuje použít další objem, aby se odstranila veškerá DNA.
Pro kolony je rozhodující rychlost eluce. Příliš pomalá rychlost zvýší pravděpodobnost degradace molekuly; příliš rychlá a nedojde k rozlišení frakcí.
U velkoobjemových kolon je třeba shromažďovat eluční frakce, protože vaše molekula bude rozdělena mezi ně. První frakce bude obsahovat směs promývacího a elučního pufru a případnou kontaminaci, která nebyla odstraněna promývacím pufrem.
Můžete sledovat OD pro váš typ molekuly (260nm/280nm pro DNA) a provést blot pro koncentraci vaší konkrétní molekuly v každé frakci. V nejjednodušším případě bude distribuce vašich molekul sledovat jednoduchou zvonovou křivku, ale může mít jeden nebo více ostrých píků.
Na závěr vám znalost základních parametrů vašeho experimentu (absorbent, velikost kolony, promývací pufr, eluční pufr, průtoková rychlost, počet frakcí) a obecných principů eluce umožní úspěšně nastavit vaši eluci.
Pro podrobnější informace si najděte článek, kde jiní vědci dělali něco podobného – ideálně stejnou molekulu, ale podobná postačí – a přizpůsobte ji svým podmínkám.
Napsat komentář