Introduction
Návrh a výroba nanokompozitů jíl/polymer se těší velkému zájmu vědecké i technické komunity (Cheng et al., 2017). Byla vyvinuta široká škála nanokompozitů jíl/polymer, které se široce používají (Gogoi a Raidongia, 2017). Široce rozšířeným přístupem k přípravě nanokompozitů jíl/polymer je předběžná interkalace jílů s následnou inkorporací polymerů do vrstvy jílových minerálů (Li et al., 2009; Zare et al., 2017). Při interkalaci do anorganických jílových vrstev organické polymerní řetězce přirozeně snižují svou strukturní mobilitu a některé z nich nabývají ve vrstevnaté struktuře vysoce organizované konformace.
V přírodě je kaolinit (Kaol) typem jílového minerálu s vrstevnatou strukturou 1:1 dioktaedrického křemičitanu hlinitého (Brindley a Robinson, 1945). Vrstvy v kaolu drží pohromadě vodíkové vazby, dipólově-dipólové interakce a van der Waalsovy síly (Brindley a kol., 1967). Do galerie Kaol se však podařilo interkalovat pouze omezený počet vysoce polárních organických látek, včetně močoviny (Makó et al., 2009), dimethylsulfoxidu (Costanzo a Giesse, 1986), formamidu (Frost et al., 2000a), hydrazinu (Cruz a Franco, 2000) a octanu draselného (Frost et al., 2000b). Interkalace malých molekul do vrstev Kaolu způsobuje zvětšení bazální rozteče a může být použita jako předběžný expanzní krok pro následné vložení velkých nereaktivních druhů vytěsněním předem interkalovaných malých molekul (Cheng et al., 2015). Na základě předchozích zpráv může být například interkalační sloučenina Kaol/methanol účinným meziproduktem pro další interkalační reakci s ethylenglykolem (Hirsemann a kol., 2011), hexylaminem (Matusik a kol., 2012), n-alkylaminy (Gardolinski a Lagaly, 2005) a kvartérními amonnými solemi (Cheng a kol., 2016). Kromě toho se většina hostujících molekul obtížně vkládá do mezivrstvového prostoru, jedním z důvodů jsou silné vodíkové vazby, dalším důvodem je, že ve struktuře Kaolu nejsou žádné výměnné ionty.
Ačkoli nanokompozity jíl/polymer byly v posledních letech dobře vyvinuty, syntetizovat nové nanokompozity jíl/organické látky pro potenciální použití stále představuje velkou výzvu (Kotal a Bhowmick, 2015). Pro vyřešení tohoto problému je skutečně naléhavou záležitostí zjistit proces interkalace kaolinitu v nano měřítku a důkladně prozkoumat mechanismus rozkladu pomocí moderních technologií a analytických nástrojů. Termická analýza a kinetický výpočet interkalačních sloučenin jílu a polymerů mohou pomoci charakterizovat rozkladné procesy a poskytnout vědecký základ pro kontrolu interkalačních reakcí (Zhang et al., 2015). Kinetické parametry kinetiky procesu rozkladné reakce, jako je aktivační energie, preexponenciála, reakční řády a rychlostní konstanta, byly vyhodnoceny pomocí údajů z termogramů jílu/polymeru. V této studii byla zkoumána interkalace Kaolu s různými alkylaminy. Additionally, the intercalation process and the decomposition mechanism was systematically investigated.
Experimental
Materials
Kaolin použitý v této studii byl využit z Zhangjiakou, Čína. Hlavním minerálním složením je dobře uspořádaný kaolinit (95 % hmotnosti). Před interkalací byl rozemlet tak, aby prošel sítem o velikosti 325 ok (částice o velikosti < 44 μm). Alkylamin hexylamin (HA, 99 %), dodecylamin (DA, chemicky čistý) a oktadecylamin (OA, chemicky čistý) byly zakoupeny od společnosti Nanjing Shuguang Chemical Company, Čína. Dimethylsulfoxid (DMSO, analytické činidlo), methanol (MeOH, analytické činidlo) a toluen (99 %) byly získány od společnosti Xilong Chemical Company, Čína, a použity tak, jak byly obdrženy, bez dalšího čištění. Chemický vzorec a strukturní vzorec HA, DA a OA jsou uvedeny v tabulce 1.

Tabulka 1. Chemický a strukturní vzorec HA, DA a OA.
Syntéza interkalačních sloučenin
Nejprve byla připravena interkalační sloučenina Kaol/DMSO rozptýlením 20,0 g Kaolu do směsi 36,0 g DMSO a 4,0 g vody. Směs byla míchána ve vodní lázni po dobu 2 h při 95 °C a poté byla suspenze oddělena odstředěním ethanolem. Za druhé, interkalační sloučenina Kaol/DMSO byla použita jako prekurzor pro další reakci s MeOH. K předinterkalovanému Kaolu byl přidán MeOH a reakční směs byla míchána po dobu 10 dnů, přičemž MeOH byl každý den nahrazen stejným množstvím čerstvého MeOH. Sraženina ve směsi byla oddělena odstředěním a sušena v sušárně při 60 °C po dobu 12 h, čímž byly získány interkalační sloučeniny Kaol/MeOH. Nakonec byly 2 g interkalační sloučeniny Kaol/MeOH za míchání při pokojové teplotě smíchány s 30,0 ml roztoků HA, DA, resp. methanolu OA (1 mol/l). Disperze byly po reakci odstředěny po dobu 24 h. Sedimenty byly třikrát promyty toluenem, aby se odstranil přebytek HA, DA nebo OA. Vzorky byly sušeny při pokojové teplotě po dobu 12 h a rozemlety na prášek pomocí achátového moždíře (Komori et al., 1999). Výsledné sloučeniny jsou označeny jako Kaolpi/HA (pí jako předinterkalované), Kaolpi/DA a Kaolpi/OA.
Charakterizace
Rentgenové difraktometry byly zaznamenány na rentgenovém difraktometru Rigaku D/max 2500PC se zářením Cu Kα (λ = 1,54178 Å) pracujícím při 40 kV a 150 mA. Vzorky náhodně orientovaných vzorků byly skenovány v rozsahu 2θ mezi 1° a 20° rychlostí 2° min-1. K záznamu FTIR spekter v rozsahu 4 000 ~ 400 cm-1 byl použit spektrofotometr Thermo Fisher Nicolet 6700. Analýzy TG-DSC byly provedeny na simultánním tepelném analyzátoru Mettler-Toledo TG-DSC I/1600 HT v dusíkové atmosféře. Dvacet miligramů vzorku bylo umístěno do kelímku z oxidu hlinitého a zahříváno od 30 do 1100 °C s řadou rychlostí zahřívání 4, 6, 8, 10 °C min-1.
Výsledky a diskuse
XRD charakterizace
Na obrázku 1 jsou uvedeny XRD obrazce nedotčeného Kaolu a jeho interkalačních sloučenin. Vzor nedotčeného Kaolu vykazuje dobře uspořádanou vrstevnatou strukturu s bazální roztečí 0,71 nm. Tato hodnota dobře odpovídá standardnímu referenčnímu vzoru ICDD 14-0164 . Po ošetření DMSO se objevil nový bazální reflexní pík při 1,14 nm, což naznačuje, že DMSO byl úspěšně vložen do mezivrstev Kaolu. Poté, co byla interkalační sloučenina Kaol/DMSO ošetřena MeOH, byl odrazový pík 1,14 nm (001) charakteristický pro interkalační sloučeninu Kaol/DMSO posunut na 0,86 nm. Matusik et al. (2012) uvádí, že při sušení sloučeniny Kaol/DMSO/MeOH při 110 °C zmizel odraz s d = 1,12 nm a byl pozorován široký odraz s maximem při 0,95 nm. Na základě chemického vzorce Al2Si2O5(OH)3.20(OCH3)0.80 interkalační sloučeniny Kaol/DMSO, který byl vypočten na základě analýzy CHNS, se ukázalo, že přibližně 1/3 vnitřních povrchových OH skupin byla nahrazena methoxy skupinami, a toto pozorování rovněž naznačuje vznik interkalační sloučeniny Kaol/MeOH (Tunney a Detellier, 1996; Cheng a kol., 2015). Vzorky XRD také ukazují, že sloučeniny Kaol/MeOH interkalované s HA, DA a OA rozšiřují strukturu podél osy c, což vede k velké mezivrstevní vzdálenosti 2,86, 4,08 a 5,66 nm. Délky molekulárních řetězců HA, DA a OA jsou 1,56, 2,51 a 3,65 nm (McNulty et al., 2011, 2014). Celkově se mezivrstvá vzdálenost interkalačních sloučenin Kaol/alkylamin zvětšuje s délkou alkylového řetězce alkylaminů, ale molekula alkylaminu netvoří jednovrstvou nebo dvouvrstvou strukturu, která je kolmá na povrch Kaolu.
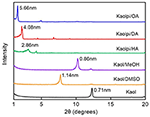
Obrázek 1. XRD obrazce Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA a Kaolpi/OA.
FTIR spektra
FTIR spektroskopie se široce používá při charakterizaci interkalačních sloučenin (Ledoux a White, 1964; Frost a kol., 2000c; Cheng a kol., 2012). FTIR spektra původních interkalačních sloučenin Kaol, Kaolpi/HA, Kaolpi/DA a Kaolpi/OA jsou znázorněna na obrázku 2. Charakteristické pásy při 432, 470 a 541 cm-1 (obr. 2B) patří deformačnímu módu Si-O, Si-O-Si a Al-O-Si. Další pásy při 1 009, 1 031 a 1 114 cm-1 (obr. 2C) jsou přiřazeny strečovým vibracím Si-O-Si ve vrstvě Kaol. Při porovnání spekter Kaolu a jeho interkalačních sloučenin nemá poloha pásů žádné zjevné změny, což naznačuje, že tyto pásy protahovacích vibrací nejsou ovlivněny interkalovanými molekulami.
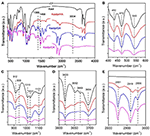
Obrázek 2. Obrázek 2: Pásy protahovacích vibrací ve vrstvě Kaol. Infračervená spektra Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Pásy při 912 a 938 cm-1 (obr. 2C) patří deformaci OH vnitřních hydroxylových skupin a hydroxylových skupin na vnitřním povrchu. Ve spektru původního Kaolu jsou zřejmé čtyři hydroxylové stretchingové pásy při 3,694, 3,669, 3,652 a 3,620 cm-1 (obr. 2D), přičemž pásy při 3,694, 3,669 a 3,652 cm-1 jsou způsobeny vnitřně-povrchovými hydroxylovými skupinami, zatímco pás při 3,620 cm-1 je výsledkem vnitřních hydroxylových skupin (Farmer, 1964; Ledoux a White, 1964; Giese a Datta, 1973). Po interkalaci molekul alkylaminu došlo k zeslabení některých pásů v důsledku změny interakcí se sousedními atomy. Posun k 3,697 cm-1 a pokles intenzity pásu při 3,694 cm-1 naznačuje, že se četné hydroxylové skupiny v Kaolu účastnily a vytvořily vodíkové vazby s aminovými skupinami v molekulách alkylaminu (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
Přítomnost mezivrstevných molekul alkylaminu byla na FTIR spektru detekována novými píky, které jsou znázorněny na obr. 2A,E. U interkalačních sloučenin patří některé zjevné charakteristické píky, jako je pás při 1 388 a 1 468 cm-1 , k ohybovému módu C-H -CH3 a -CH2. Byl pozorován nový vibrační pás při 3 334 cm-1 , který je způsoben strečovým módem protahovací vibrace N-H (Griffiths a De Haseth, 2007; Zhang a kol., 2018). Byl pozorován nový vibrační pás při 2 956 cm-1 , který se obvykle přiřazuje asymetrickému strečovému pásu C-H terminálních methylových skupin (Cheng et al., 2016). Dva vibrační pásy při 2,919 a 2,851 cm-1 se obvykle přiřazují symetrickým a asymetrickým strečovým vibracím -(CH2)n- (Venkataraman a Vasudevan, 2001). Intenzita pásů se postupně zvyšuje, což znamená, že do mezivrstev Kaolu bylo vloženo více atomů uhlíku alkylaminu. Kromě toho se těkavost alkylaminů snižuje s nárůstem uhlíkového řetězce, takže stabilita příslušných interkalačních sloučenin Kaol se postupně zvyšuje s větší molekulovou hmotností alkylaminu (Wang a kol., 2010).
Strukturní model interkalačních sloučenin Kaol/alkylamin
Uspořádání interkalovaných molekul je základem pro experimentální analýzu struktury interkalačních sloučenin Kaol/alkylamin. Podle Lagalyho (1981) lze strukturní modely interkalačních sloučenin montmorillonitu a kvarterní amonné soli rozdělit do tří kategorií: (a) monovrstvy: alkylaminové ionty s krátkým řetězcem; b) dvojvrstvy: kvartérní amonné ionty s dlouhým řetězcem; c) třívrstvy: zalomené alkylové řetězce ve vysoce nabitých jílových minerálech. Beneke a Lagaly (1982) dále navrhli různé struktury interkalovaných alkylaminových molekul na základě XRD, které jsou shrnuty následovně: (a) alkylové řetězce v mezivrstvovém prostoru jsou nakloněny ke krystalové rovině (001); b) alkylové řetězce jsou uspořádány do dvojvrstev. Brindley a Moll (1965) popsali, že interkalární molekuly jsou nakloněny k silikátovým listům v jedné vrstvě, zatímco úhel je přibližně 65° ke krystalové rovině (001). Pokud jsou interagující molekuly rovnoměrně připojeny ke všem silikátovým povrchům aktivními hydroxylovými skupinami, nabízí se uspořádání „end to end“ v párech s určitým podélným posunem. Úhel sklonu je v souladu s možným způsobem těsného balení mezi silikátovými kyslíkovými povrchy a koncovými hydroxylovými skupinami a stupněm těsného balení řetězcových molekul mezi sebou.
Alkylové molekuly těžko interkalují přímo původní vrstvy Kaolu, protože chybí výměnné ionty v mezivrstvovém prostoru Kaolu. Při vkládání alkylaminových molekul do mezivrstvy Kaolu jsou nezbytné platné prekurzory. Bylo zjištěno, že řetězec alkyltrimethylchloridu amonného vytváří v mezivrstvě Kaolu nakloněnou dvojvrstvu a úhel naklonění je po výpočtu ~36° (Kuroda a kol., 2011). Yuan et al (2013) poukázali na to, že strukturní uspořádání molekul kvartérní amonné soli v mezivrstvě Kaolu je nakloněná dvojvrstva a úhel naklonění je ~38,4°. Gardolinski a Lagaly (2005) navrhli, že alkylové řetězce v mezivrstvách jsou dvojvrstvou Kaol zcela protaženy a orientovány kolmo k povrchu. Z analýzy délky řetězce molekul HA, DA a OA lze tedy vyvodit závěr, že bazální rozteč po interkalaci není dostatečná, aby umožnila vstup alkylového řetězce vertikálním a dvojvrstvým způsobem. Z další analýzy výsledků XRD je patrné, že alkylové řetězce HA, DA a OA jsou v dvojvrstvě nakloněny ke Kaolovu povrchu a úhel sklonu alkylových řetězců je přibližně 39,9, 39,9, resp. 41,1°. Kromě toho, vzhledem k hydroxylové vazbě mezi hydroxylem na vnitřním povrchu Kaolu a aminovými skupinami v molekulách alkylaminů, je nejpravděpodobnější strukturní model interkalačních sloučenin Kaol/alkylamin znázorněn na obrázku 3.
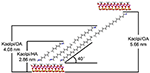
Obrázek 3. Nejpravděpodobnější strukturní model interkalačních sloučenin kaolinitu a alkylaminu.
Termická analýza
Výsledky TG-DSC analýzy kaolu a jeho interkalačních sloučenin jsou uvedeny na obr. 4. Hlavní hmotnostní úbytek Kaolu je mezi 400 a 600 °C, přičemž maximální rychlost úbytku při teplotě 525 °C se připisuje úbytku vody v důsledku dehydroxylace krystalové mřížky, což vede ke vzniku metakaolinitu (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Tato ztráta odpovídá přibližně 12,7 % celkové hmotnosti, což je velmi blízko teoretické referenční hodnotě (13,9 %). Porovnáním TG-DSC křivek původního Kaolu lze u interkalačních sloučenin Kaolpi/HA, Kaolpi/DA a Kaolpi/OA pozorovat dva hlavní stupně úbytku hmotnosti. K prvnímu došlo mezi 150 a 350 °C, což je způsobeno rozkladem interkalovaných molekul alkylaminu (Yuan et al., 2013). Druhý, ke kterému došlo při teplotě přibližně 500 °C, je způsoben dehydroxylací deinterkalovaného Kaolu. V případě Kaolpi/OA byly některé OA interkalovány do silikátového mezivrstvového prostoru za vzniku stabilní interkalace, což lze prokázat XRD obrazem. Některé molekuly jsou do sebe zapleteny v důsledku dlouhého řetězce nebo svorky v nanovrstvách, kterou nelze zcela odstranit (Li et al., 2015; Liu et al., 2016). Při teplotě 220 °C je zřetelný úbytek hmotnosti způsoben rozkladem obaleného nebo nevázaného OA, zatímco úbytek hmotnosti při teplotě 330 °C se připisuje rozkladu interkalovaného OA. Exotermický pík při 996 °C je důsledkem rekrystalizace Kaolu.
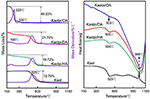
Obrázek 4. Při teplotě 996 °C dochází ke krystalizaci Kaolu. TG-DSC křivky pro Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Při porovnání TG-DSC křivek původního Kaolu a interkalačních sloučenin Kaol/alkylamin (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA) lze pozorovat: (a) rozdílné stupně úbytku hmotnosti, jakož i výrazný rozdíl v úbytku hmotnosti mezi Kaolpi/OA a dalšími dvěma interkalačními sloučeninami (Kaolpi/HA, Kaolpi/DA). Hmotnostní ztráty při rozkladu Kaolpi/HA a Kaolpi/DA činily přibližně 20 %, ale výše obou hmotnostních ztrát u Kaolpi/OA je přibližně 50 %. To by mohlo být způsobeno tím, že do silikátového mezivrstvového prostoru bylo interkalováno větší množství OA než u HA a DA (Wang et al., 2017). (b) Teplota dehydroxylace interkalačních sloučenin byla nižší než u původní Kaol přibližně o 20 °C. Je to proto, že interkalační molekuly rozšířily mezivrstevní prostor, oslabily vodíkové vazby mezi vrstvami Kaol, což přineslo snadnější dehydroxylaci z povrchu Kaol. Proto se krystalinita Kaolu po interkalaci prudce snížila, což lze potvrdit pomocí XRD a IR (pod 800 cm-1). Tento výsledek je v souladu se závěry některých jiných zpráv, že teplota dehydroxylace byla určena krystalinitou Kaolu (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Kinetika rozkladné reakce
Kinetika rozkladu interkalační sloučeniny Kaol/alkylamin byla zkoumána pomocí termogravimetrických technik. Kinetické parametry (aktivační energie E a preexponenciální faktor A) degradačního procesu byly vypočteny na základě metod KAS a Ozawa (Kissinger, 1957; Škvára a Šesták, 1975). Mechanismus tepelné degradace interkalační sloučeniny Kaol/alkylamin byl studován pomocí Satavovy integrální metody (Xie et al., 2001; Gao et al., 2005; Zhang et al., 2015).
Podle reakční teorie se kinetický vzorec neizotermického rozkladu obvykle vyjadřuje takto:
kde α je míra přeměny B(s) v čase t, f (α) je funkce reakčního mechanismu a k je konstanta reakční rychlosti. k se řídí následující rovnicí:
Je-li teplota vzorku řízena konstantní rychlostí ohřevu (β = dT/dt), lze reakční rychlost definovat takto:
Po oddělení proměnné, přeuspořádání pomocí integrálních nebo diferenciálních funkcí rovnice (4), lze rovnici KAS (5) a Ozawovu rovnici (6) vypočítat takto:
Kde G(α) představuje integrální funkci převodu. Vzhledem k integrální aproximaci byly pro výpočet E použity iterační metody, aby se zabránilo určitým odchylkám. Funkce iteračních metod jsou následující:
Zadáme x = E/RT, definice h(x) a H(x) jsou:
Iterace probíhají v následujících třech krocích:
(a) Nastavíme h(x) = 1 nebo H(x) = 1, vypočítáme E0 metodou nejmenších čtverců podle sklonu lineárního vztahu lnβ/T2 a lnβ k 1/T. Při výpočtu se postupuje podle následujícího vzorce.
(c) Nahraďte E0 hodnotou E1, opakujte krok (b), dokud Ei-Ei-1 < 0. 1 kJ mol-1. Ei je přesná hodnota aktivační energie rozkladné reakce.
E-hodnoty interkalačních sloučenin Kaol/alkylamin byly vypočteny metodami KAS, Ozawa a iterační metodou (tabulka 2). Vypočtené výsledky získané metodou KAS se blížily výsledkům z iteračních metod, avšak výsledky z Ozawovy iterační metody vykazovaly větší odchylku od ostatních. Proto lze průměrnou E z iteračních metod považovat za aktivační energii rozkladné reakce, protože jsou lepší než metody KAS a Ozawa. Průměrné E metod Kaolpi/HA, Kaolpi/DA a Kaolpi/OA jsou 104,44, 130,80 a 154,59 kJ mol-1. Je vidět, že průměrné E mezi sloučeninami Kaol/alkylamin jsou v pozitivní korelaci s délkou alkylového řetězce. Jedním z důvodů je, že těkavost slábne s rostoucí délkou alkylového řetězce. Dalším důvodem je, že Kaolpi/OA mají nejlépe uspořádanou interkalační strukturu, která se nejhůře deinterkaluje. A tyto výsledky lze potvrdit pomocí XRD vzorků.
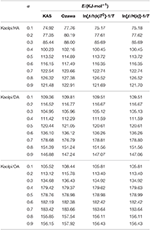
Tabulka 2. E interkalačních sloučenin Kaol/alkylamin s různým α vypočtené metodami KAS, Ozawa a iterační metodou.
Funkce a A mechanismu rozkladné reakce byly vypočteny metodami Satava, které byly popsány následovně:
Při dosazení α do každé funkce mechanismu G(α) se získá hodnota lg, lineární fitování lg a 1/T, která odpovídá rychlosti ohřevu, přičemž funkci, která má největší fitování, lze určit jako nejpravděpodobnější funkci mechanismu. A hodnoty E a A lze získat pomocí sklonu a průsečíku lineární fitovací křivky.
Jak ukazuje tabulka 3, na základě Satavova integrálního vzorce bylo vybráno pět funkcí mechanismu s dobrou shodou nad 90 %. Porovnáním těchto pěti funkcí lze za nejpravděpodobnější funkci mechanismu považovat funkci mechanismu č. 9 G(α) = 2 s dobrou shodou přibližně 97 % a lineární fitovací křivky funkce č. 9 byly zobrazeny na obrázku 5. E a A jsou rovněž v normálním rozsahu kinetiky rozkladu. Funkce mechanismu rozkladu pro tři interkalační sloučeniny Kaol/alkylamin jsou uvedeny v tabulce 4.

Tabulka 3. Vybrané funkce kinetického mechanismu posouzené Satavovou integrální metodou.

Obrázek 5. Lineární fitovací křivky funkce č. 9 posouzené Satavovou integrální metodou.

Tabulka 4. Funkce kinetického mechanismu interkalačních sloučenin Kaol/alkylamin.
Závěry
Možné modely struktury a kinetika rozkladu interkalačních sloučenin Kaol/alkylamin byly studovány pomocí XRD, FT-IR a TG-DSC. Interkalace sloučeniny Kaol/MeOH s HA, DA a OA rozšiřuje mezivrstvovou vzdálenost Kaolu podél osy c, což vede k tomu, že dominantní odraz se objevuje při 2,86, 4,08 a 5,66 nm. Navíc bazální rozteč po interkalaci není dostatečná, aby umožnila vstup alky řetězce vertikálním jednovrstvým a dvouvrstvým způsobem. Byl učiněn závěr, že alky řetězce HA, DA a OA jsou v dvojvrstvě nakloněny k povrchu Kaolu a úhel sklonu alky řetězců je ~40°.
Na základě metod KAS, Ozawa a iteračních metod byly vypočteny výsledky aktivační energie E interkalačních sloučenin Kaol/alkylamin. Průměrné hodnoty aktivační energie E Kaolpi/HA, Kaolpi/DA a Kaolpi/OA jsou 104,44, 130,80 a 154,59 kJ mol-1 . Průměrná aktivační energie E mezi sloučeninami Kaol/alkylamin má pozitivní korelaci s délkou alkylového řetězce. Optimalizovaná funkce mechanismu rozkladného procesu Kaol/alkylamin byla stanovena jako 3D difúze s integrální funkcí G(α) = 2. Tento výzkum je výhodný pro lepší pochopení mechanismu rozkladu jílu/organických nanokompozitů a navíc poskytuje inspiraci pro syntézu nových materiálů na bázi jílu.
Příspěvky autorů
HC a QfL navrhli experiment a revidovali článek. YZ, QhL a PX provedli experimenty a napsali článek. YZ a QhL se na této práci podíleli rovným dílem.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Dr. Luyi Sun (Department of Chemical and Biomolecular Engineering and Polymer Program, Institute of Materials Science, University of Connecticut) děkujeme za revizi článku. Autoři děkují za finanční podporu poskytnutou National Natural Science Foundation of China (41602171), Beijing Natural Science Foundation (8164062) a Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing.
Giese, R., and Datta, P. (1973). Hydroxylová orientace v kaolinitu, dickitu a nakritu. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). Infračervená spektrometrie s Fourierovou transformací. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., and Guggenheim, S. (1985). Dehydroxylace kaolinitu. Am. Mineral. 70, 1-2.
Google Scholar
.
Napsat komentář