Mezi prvky skupiny 13 patří kovy po přechodu.
Termín kovy po přechodu označuje prvky, které jsou kovy po kovech přechodných. Stejně jako u pojmu metaloid neexistuje všeobecná shoda v tom, co přesně je kov po přechodu. V praxi naštěstí není tak důležité přesně definovat, co je a co není kov po přechodu, jako spíše pochopit důvod, proč by mohlo být užitečné klasifikovat prvky jako kovy po přechodu.
Hlavními znaky kovů po přechodu je, že jsou relativně elektronově bohaté a elektronegativní ve srovnání s tím, co se klasicky považuje za kov. Zhruba se to projevuje relativně nižšími teplotami tání (protože v pásové struktuře bývá obsazeno více antivazebných hladin), zvýšenou preferencí kovalence a větší křehkostí než u ostatních kovů (v důsledku výsledné směrové vazby). Jejich elektronové bohatství znamená, že mají tendenci tvořit měkké kationty.
Pro klasifikaci prvků podle příslušnosti k postpřechodným kovům se používá několik systémů. Mezi hlavní patří:
- Kovy, které následují po d-bloku. Podle této definice sem patří pouze kovy 13. a vyšší skupiny a 3. a vyšší řady, které tvoří relativně měkké a elektronově bohaté kationty a ve vazbě vykazují značnou kovalenci. Pokud je však toto schéma přijato příliš rigidně, je vyloučen Al, protože technicky nesleduje d-blok (a má nevyplněnou (n-1)d podpouzdro), a jsou vyloučeny metaloidy, přestože mnohé z nich také tvoří relativně měkké a elektronově bohaté kationty s vyplněným (n-1)d podpouzdrem. Další nevýhodou tohoto systému je, že zaplétá otázku, které prvky by měly být klasifikovány jako kovy po přechodu, s ožehavou otázkou, které prvky by měly být klasifikovány jako kovy vs. metaloidy.
- Kovy a metaloidy p-bloku. Tento systém má tu výhodu, že zdůrazňuje zajímavé a jedinečné vlastnosti kovů a metaloidů p-bloku a také kontinuitu těchto vlastností přes p-blok. Proto bude použit v následujících oddílech. Má však tu nevýhodu, že vylučuje kovy jako Zn, Cd a Hg, které tvoří mnoho sloučenin, v nichž má kov konfiguraci (n-1)d10.
- Kovy, které následují přechodné prvky ve smyslu tvorby iontů se zcela plnou valenční slupkou (n-1)d, někdy spolu s Al a metaloidy p-bloku. Tato definice přidává Zn, Cd a Hg (a někdy Cu, Ag a Au), protože tvoří ionty s (n-1)d 10 valenční elektronovou konfigurací, jako jsou Zn2+, Cd2+ a Hg2+(a Cu+, Ag+ a Au+). Vzhledem k tomu, že v této kapitole se uvažuje pouze o prvcích s blokem p, je pro účely této kapitoly tento systém funkčně totožný se systémem 2.
Ať už použijeme jakékoli klasifikační schéma, je často užitečnější uvažovat o klasifikaci prvků jako o post-tranzitních kovech jako o způsobu, jak zdůraznit podobnosti v chemických vlastnostech souboru prvků, než jako o způsobu, jak zdůraznit, jak se post-tranzitní kovy liší od ostatních kovů. Posttranzitní kovy nejsou jediné, které tvoří měkké kationty nebo sloučeniny lépe popsané jako držené pohromadě kovalentními vazbami. Jak vyplynulo z předchozích oddílů, i alkalické kovy tvoří za vhodných okolností anionty a mnoho sloučenin kovů je lépe popsáno z hlediska kovalentních než iontových interakcí. To bylo patrné již v chemii kovů alkalických zemin Be a Mg, o nichž byla řeč v předchozí části. V následujících kapitolách budou vazby a reaktivita v koordinačních komplexech a organokovových sloučeninách z velké části popsány kovalentně.
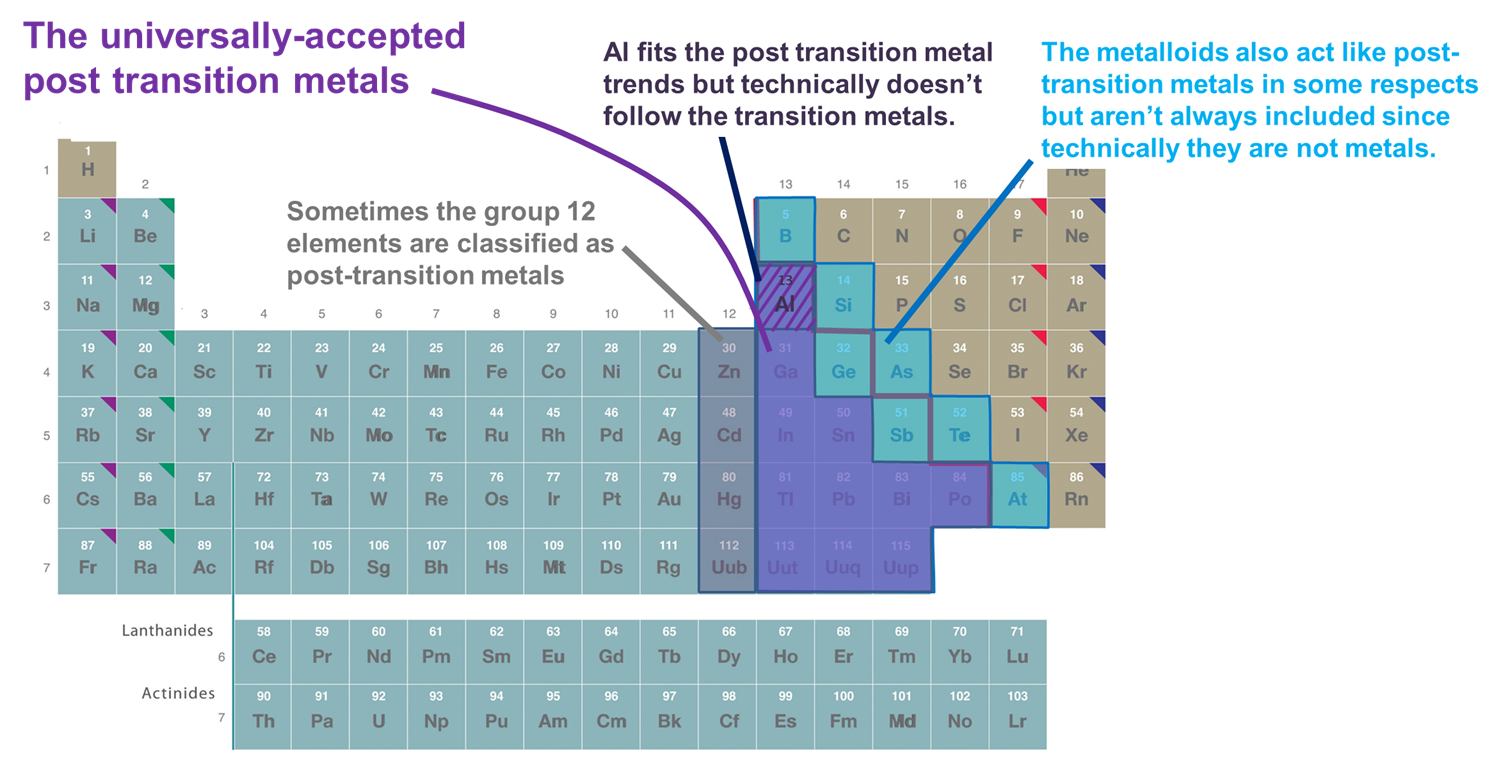
Obrázek \(\sf{\PageIndex{2}}). Některé prvky klasifikované jako kovy po přechodu. Ty, které jsou znázorněny fialovou barvou, jsou běžně přijímány, protože jsou to kovy a jasně následují po přechodných kovech, zatímco kovy ve skupinách 12 (a někdy 11), Al a metaloidy jsou někdy zahrnuty, protože se v důležitých ohledech chovají jako ostatní kovy po přechodu. Periodická tabulka je převzata z tabulky na adrese https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molecules%2C_and_Ions/2.5%3A_The_Periodic_Table.
.
Napsat komentář