Molekulární dipólové momenty
V molekulách obsahujících více než jednu polární vazbu je molekulární dipólový moment pouze vektorovou kombinací toho, co lze považovat za jednotlivé „vazebné dipólové momenty“. Z matematického hlediska jsou dipólové momenty vektory; mají velikost i směr. Dipólový moment molekuly je tedy vektorový součet dipólových momentů jednotlivých vazeb v molekule. Pokud se dipólové momenty jednotlivých vazeb navzájem vyruší, nevznikne žádný čistý dipólový moment. To je případ CO2, lineární molekuly (obrázek \(\PageIndex{1a}\)). Každá vazba C-O v CO2 je polární, přesto experimenty ukazují, že molekula CO2 nemá žádný dipólový moment. Protože dipóly obou vazeb C-O v CO2 jsou stejně velké a vzájemně orientované pod úhlem 180°, ruší se. V důsledku toho nemá molekula CO2 žádný čistý dipólový moment, přestože má značně oddělený náboj. Naproti tomu molekula H2O není lineární (obrázek \(\PageIndex{1b}\)); je ohnutá v trojrozměrném prostoru, takže dipólové momenty se vzájemně neruší. Molekula jako H2O má tedy čistý dipólový moment. Očekáváme, že koncentrace záporného náboje bude na kyslíku, elektronegativnějším atomu, a kladný náboj na dvou vodících. Tato polarizace náboje umožňuje H2O vytvářet vodíkové vazby s jinými polarizovanými nebo nabitými druhy, včetně jiných molekul vody.
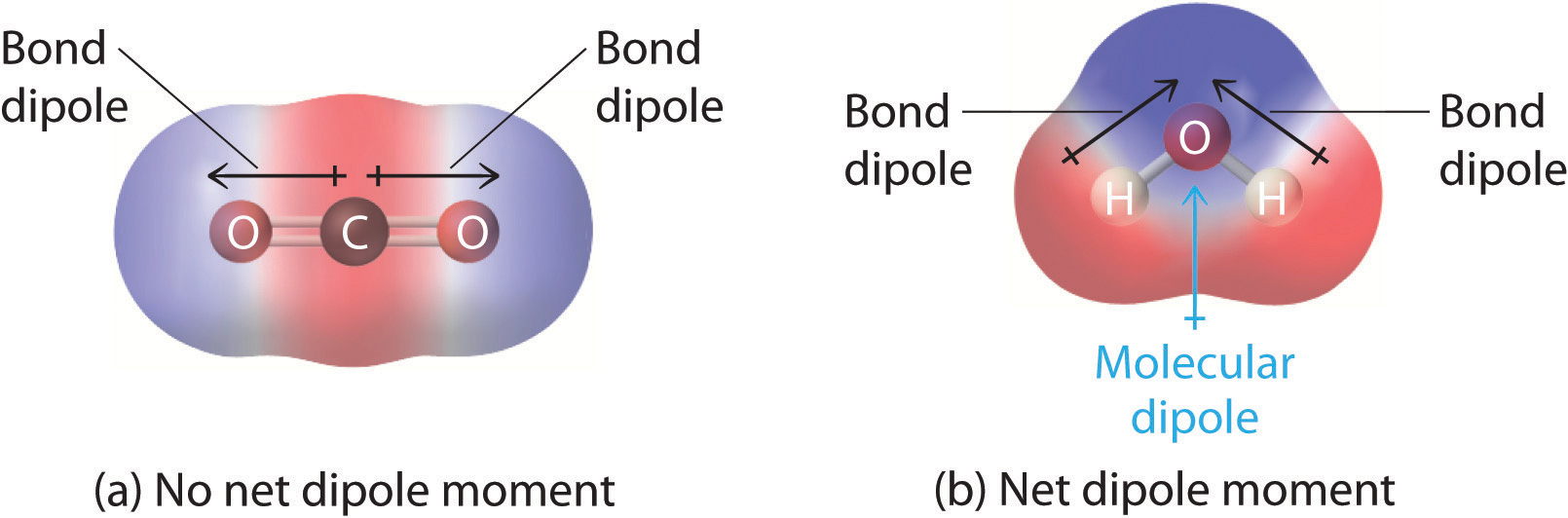
Obrázek \(\PageIndex{1}\): Jak se sčítají jednotlivé vazebné dipólové momenty, aby vznikl celkový molekulový dipólový moment pro dvě trojatomové molekuly s různou strukturou. (a) V CO2 jsou dipóly vazeb C-O stejně velké, ale orientované v opačných směrech (v úhlu 180°). Jejich vektorový součet je nulový, takže CO2 nemá žádný čistý dipól. (b) V H2O jsou dipóly vazby O-H rovněž stejně velké, ale jsou vzájemně orientovány pod úhlem 104,5°. Vektorový součet tedy není nulový a H2O má čistý dipólový moment.
Následující rovnice je zjednodušená pro jednoduchý oddělený systém dvou nábojů, který se vyskytuje v dvouatomových molekulách nebo při uvažování vazebného dipólu v molekule.
\
Tento vazebný dipól µ (řecky mu) se interpretuje jako dipól z oddělení nábojů na vzdálenost \(r\) mezi dílčími náboji \(Q^+\) a \(Q^-\) (nebo častěji používaný termín \(δ^+\) – \(δ^-\)); orientace dipólu je podél osy vazby. Jednotky pro dipólové momenty jsou obvykle debye (D), kde jeden debye je roven 3,336 x 1030 coulombmetrů (C – m) v jednotkách SI. Uvažujme jednoduchý systém jednoho elektronu a protonu, které od sebe dělí pevná vzdálenost. Jednotkový náboj elektronu je 1,60 x 1019 C a elektron protonu & jsou od sebe vzdáleny 100 pm (přibližně délka typické kovalentní vazby), dipólový moment se vypočítá takto:
\ &= (1,60 \krát 10^{-19}\, C)(1,00 \krát 10^{-10} \,m) \nečíslo \\ &= 1,60 \krát 10^{-29}. \,C \cdot m \label{2} \end{align}\]
\ &= 4,80\; D \label{3} \end{align}\]
\(4,80\; D\) je klíčová referenční hodnota a představuje čistý náboj +1 a -1 oddělený 100 pm. Pokud by se však separace nábojů zvětšila, pak dipólový moment vzroste (lineárně):
- Pokud by proton a elektron byly odděleny 120 pm:
\
- Pokud by proton a elektron dělilo 150 pm:
\
- Pokud by proton a elektron dělilo 200 pm:
\
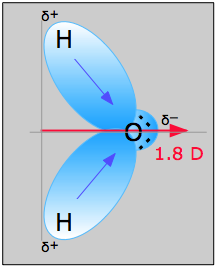
Příklad \(\PageIndex{1}\): Molekula vody na obrázku \(\PageIndex{1}\) může být použita k určení směru a velikosti dipólového momentu. Z elektronegativit kyslíku a vodíku vyplývá, že rozdíl je 1,2e pro každou z vazeb vodík-kyslík. Dále, protože kyslík je elektronegativnější atom, působí větší silou na sdílené elektrony; má také dva osamělé páry elektronů. Z toho lze vyvodit, že dipólový moment směřuje z prostoru mezi oběma atomy vodíku k atomu kyslíku. Pomocí výše uvedené rovnice se dipólový moment vypočítá jako 1,85 D vynásobením vzdálenosti mezi atomy kyslíku a vodíku rozdílem nábojů mezi nimi a následným nalezením složek každé z nich, které směřují ve směru čistého dipólového momentu (úhel molekuly je 104.5˚).
Vazbový moment vazby O-H =1,5 D, takže čistý dipólový moment je
\
.
Napsat komentář