Vypařování
Louže vody ponechaná bez zásahu nakonec zmizí. Molekuly kapaliny unikají do plynné fáze a stávají se vodní párou. Vypařování je proces, při kterém se kapalina mění na plyn. Vypařování je přeměna kapaliny na její páru pod teplotou varu kapaliny. Pokud je voda místo toho uchovávána v uzavřené nádobě, nemají molekuly vodní páry možnost uniknout do okolí, a tak se hladina vody nemění. Když se některé molekuly vody změní v páru, stejný počet molekul vodní páry zkondenzuje zpět do kapalného stavu. Kondenzace je změna stavu z plynu na kapalinu.
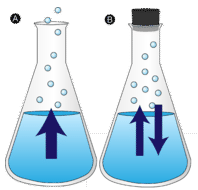
Vypařování (A) a kondenzace (B). Připomeňme, že v daném vzorku kapaliny se budou nacházet molekuly s velkým rozsahem kinetických energií. Molekuly kapaliny, které mají tuto určitou mezní kinetickou energii, uniknou z povrchu a stanou se párou. V důsledku toho mají zbývající molekuly kapaliny nyní nižší kinetickou energii. Při vypařování se teplota zbývající kapaliny snižuje. Pozorovali jste účinky odpařovacího ochlazování. Za horkého dne absorbují molekuly vody ve vašem potu tělesné teplo a odpařují se z povrchu vaší pokožky. Při odpařování zůstává zbývající pot chladnější a ten zase pohlcuje více tepla z vašeho těla.
Daná kapalina se při zahřátí odpařuje rychleji. Je to proto, že proces zahřívání vede k tomu, že větší část molekul kapaliny má potřebnou kinetickou energii, aby unikla z povrchu kapaliny. Na obrázku níže je znázorněno rozložení kinetické energie molekul kapaliny při dvou teplotách. Počet molekul, které mají potřebnou kinetickou energii k vypařování, je znázorněn ve stínované oblasti pod křivkou vpravo. Kapalina o vyšší teplotě \(\levá( T_2 \pravá)\) má více molekul, které jsou schopny uniknout do fáze páry, než kapalina o nižší teplotě \(\levá( T_1 \pravá)\).
.
Napsat komentář