Vazba v acetylenu
Koncept hybridního orbitalu se dobře uplatňuje i u skupin s trojnou vazbou, jako jsou alkyny a nitrily. Uvažujme například strukturu ethynu (obecný název acetylén), nejjednoduššího alkynu.
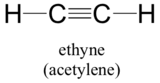
Tato molekula je lineární: všechny čtyři atomy leží v přímce. Trojná vazba uhlík-uhlík je dlouhá pouze 1,20Å. V hybridním orbitálním obrazu acetylenu jsou oba uhlíky sp-hybridizovány. U sp-hybridizovaného uhlíku se orbital 2s spojí s orbitalem 2px a vytvoří dva sp hybridní orbitaly, které jsou vůči sobě orientovány pod úhlem 180° (např. podél osy x). Orbitaly 2py a 2pz zůstávají nehybridizované a jsou orientovány kolmo podél osy y a z.


Vazba C-C sigma tedy vzniká překrytím jednoho orbitalu sp z každého z uhlíků, zatímco dvě vazby C-H sigma vznikají překrytím druhého orbitalu sp na každém uhlíku s orbitálem 1s na vodíku. Každý atom uhlíku má ještě dva zpola zaplněné orbitaly 2py a 2pz, které jsou kolmé jak na sebe navzájem, tak na přímku tvořenou sigma vazbami. Tyto dva kolmé páry p orbitalů vytvářejí mezi uhlíky dvě vazby pi, což celkově vede k trojné vazbě (jedna vazba sigma plus dvě vazby pi).

Koncept hybridního orbitalu pěkně vysvětluje další experimentální pozorování: jednoduché vazby sousedící s dvojnými a trojnými vazbami jsou postupně kratší a silnější než „normální“ jednoduché vazby, například v jednoduchém alkanu. Vazba uhlík-uhlík v ethanu (struktura A níže) je výsledkem překrytí dvou orbitalů sp3.

V alkeně B je však jednoduchá vazba uhlík-uhlík výsledkem překrytí orbitalu sp2 a orbitalu sp3, zatímco v alkynu C je jednoduchá vazba uhlík-uhlík výsledkem překrytí orbitalu sp a orbitalu sp3. Všechny tyto vazby jsou jednoduché, ale vazba v molekule C je kratší a silnější než v molekule B, která je zase kratší a silnější než v molekule A.
Vysvětlení je zde poměrně jednoduché. Orbital sp se skládá z jednoho orbitalu s a jednoho orbitalu p, a má tedy 50 % charakteru s a 50 % charakteru p. Orbitaly sp2 mají pro srovnání 33 % charakteru s a 67 % charakteru p, zatímco orbitaly sp3 mají 25 % charakteru s a 75 % charakteru p. V tomto případě se jedná o orbitaly sp2 a sp3. Díky svému kulovému tvaru jsou orbitaly 2s menší a ve srovnání s orbitaly 2p drží elektrony blíže a „těsněji“ u jádra. V důsledku toho jsou vazby s překryvem sp + sp3 (jako v alkynu C) kratší a pevnější než vazby s překryvem sp2 + sp3 (jako v alkenu B). Vazby zahrnující překrytí sp3-sp3 (jako v alkenu A) jsou nejdelší a nejslabší ze skupiny, protože hybridní vazby mají charakter 75 % „p“
.
Napsat komentář