14.8 Étery
Cíle učení
- Popsat strukturní rozdíl mezi alkoholem a éterem, který ovlivňuje jejich fyzikální vlastnosti a reaktivitu.
- Pojmenovat jednoduché étery.
- Popsat strukturu a použití některých etherů.
EterS obecným vzorcem ROR′, etherOrganická sloučenina, která má atom kyslíku mezi dvěma uhlovodíkovými skupinami. lze považovat za derivát vody, ve kterém jsou oba atomy vodíku nahrazeny alkylovými nebo arylovými skupinami. Může být také považován za derivát alkoholu (ROH), ve kterém je vodíkový atom skupiny OH nahrazen druhou alkylovou nebo arylovou skupinou:
HOH→H atomynahrazují obaROR′←z OH skupinynahrazují H atomROH
Jednoduché ethery mají jednoduché obecné názvy, vytvořené z názvů skupin připojených k atomu kyslíku, za kterými následuje obecný název ether. Například CH3-O-CH2CH2CH3 je methylpropyléter. Pokud jsou obě skupiny stejné, měla by názvu skupiny předcházet předpona di-, jako například dimethylether (CH3-O-CH3) a diethylether CH3CH2-O-CH2CH3.
Molekuly éterů nemají na atomu kyslíku žádný atom vodíku (tj. žádnou skupinu OH). Proto mezi molekulami éterů neexistuje mezimolekulární vodíková vazba, a proto mají étery při dané molární hmotnosti poměrně nízké teploty varu. Etery mají skutečně přibližně stejné teploty varu jako alkany o srovnatelné molární hmotnosti a mnohem nižší než odpovídající alkoholy (tabulka 14.4 „Srovnání teplot varu alkanů, alkoholů a etherů“).
Tabulka 14.4 Srovnání bodů varu alkanů, alkoholů a etherů
| Kondenzovaný strukturní vzorec | Název | Molární hmotnost | Teplota varu (°C) | Intermolekulární vodíková vazba v čisté kapalině? |
|---|---|---|---|---|
| CH3CH2CH3 | propan | 44 | -42 | ne |
| CH3OCH3 | dimethylether | 46 | -25 | ne |
| CH3CH2OH | etylalkohol | 46 | 78 | ano |
| CH3CH2CH2CH3 | pentan | 72 | 36 | ne |
| CH3CH2OCH2CH3 | diethylether | 74 | 35 | ne |
| CH3CH2CH2CH2OH | butylalkohol | 74 | 117 | ano |
Molekuly éteru mají atom kyslíku, a zapojují se do vodíkové vazby s molekulami vody. V důsledku toho má éter přibližně stejnou rozpustnost ve vodě jako alkohol, který je s ním izomerní. Například dimethylether a ethanol (oba mají molekulový vzorec C2H6O) jsou ve vodě zcela rozpustné, zatímco diethylether a 1-butanol (oba C4H10O) jsou ve vodě sotva rozpustné (8 g/100 ml vody).
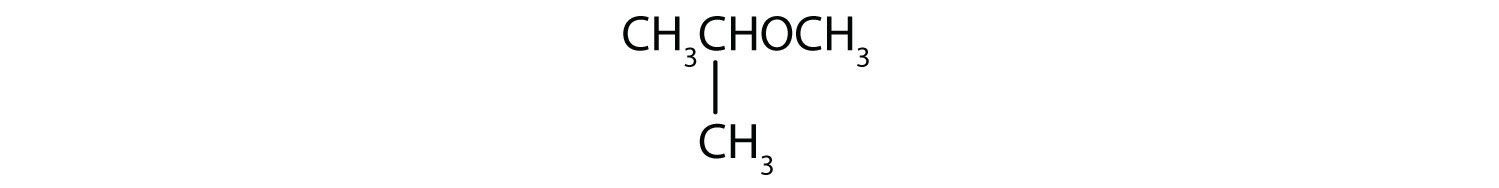
Příklad 5
Jaký je běžný název jednotlivých etherů?
- CH3CH2CH2OCH2CH2CH3
-
Roztok
- Uhlíkové skupiny na obou stranách atomu kyslíku jsou skupiny propylové (CH3CH2CH2), takže sloučenina je dipropylether.
- Tříuhlíková skupina je připojena prostředním atomem uhlíku, takže se jedná o isopropylovou skupinu. Jednouhlíková skupina je methylová skupina. Sloučenina je izopropylmethylether.
Dovednostní cvičení
-
CH3CH2CH2CH2OCH2CH2CH2CH3
-
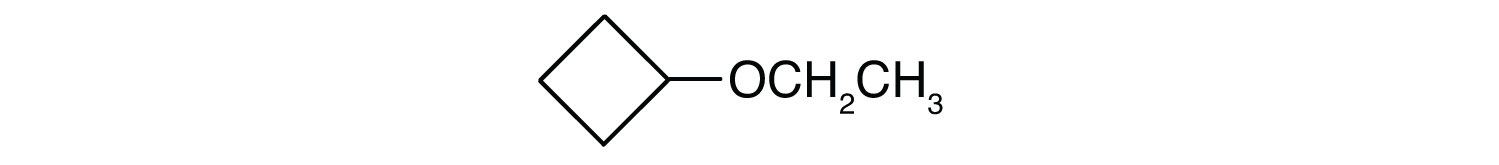
Jaký je společný název jednotlivých etherů?
Na zdraví: Etery jako celková anestetika
Celkové anestetikum působí na mozek tak, že vyvolává bezvědomí a celkovou necitlivost na pocity nebo bolest. Diethylether (CH3CH2OCH2CH3) byl prvním celkovým anestetikem, které bylo použito.
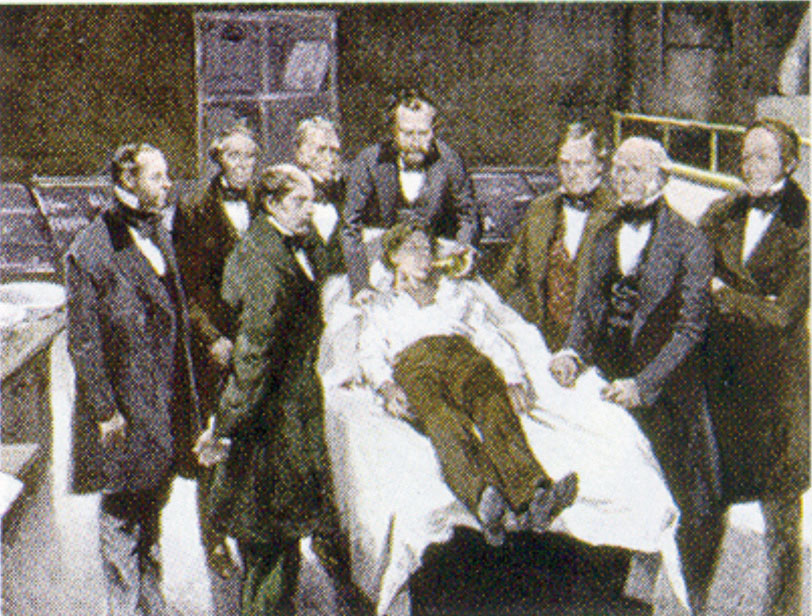
William Morton, bostonský zubař, zavedl diethylether do chirurgické praxe v roce 1846. Tento obraz zobrazuje operaci v Bostonu v roce 1846, při níž byl jako anestetikum použit diethylether. Vdechování éterových par vyvolává bezvědomí tím, že tlumí činnost centrální nervové soustavy.
Zdroj: MUDr:
Diethylether je relativně bezpečný, protože mezi dávkou, která vyvolá účinnou úroveň anestezie, a smrtelnou dávkou je poměrně velký rozdíl. Protože je však vysoce hořlavý a jeho další nevýhodou je, že způsobuje nevolnost, byl nahrazen novějšími inhalačními anestetiky, včetně sloučenin obsahujících fluor – halotanu, enfluranu a isofluranu. Bezpečnost těchto sloučenin pro personál operačních sálů je bohužel zpochybňována. Například pracovnice operačních sálů vystavené halotanu trpí vyšší mírou potratů než ženy v běžné populaci.
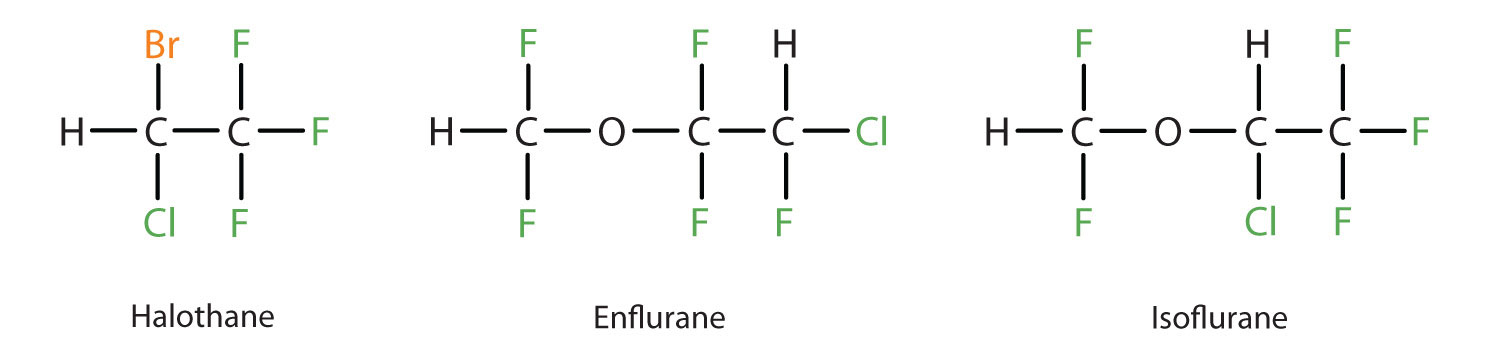
Tyto tři moderní inhalační anestetické sloučeniny obsahující halogeny jsou méně hořlavé než diethylether.
Cvičení na přehled pojmů
-
Proč má diethylether (CH3CH2OCH2CH3) mnohem nižší bod varu než 1-butanol (CH3CH2CH2CH2OH)?
-
Který z nich je rozpustnější ve vodě – diethylether (CH3CH2OCH3) nebo 1-butanol (CH3CH2CH2CH2OH)? Vysvětlete.
Odpovědi
-
Dietylether nemá mezimolekulární vodíkovou vazbu, protože nemá skupinu OH; 1-butanol má OH a zapojuje se do mezimolekulární vodíkové vazby.
-
Etylmethylether (tři atomy uhlíku, jeden atom kyslíku) je ve vodě rozpustnější než 1-butanol (čtyři atomy uhlíku, jeden atom kyslíku), i když oba mohou vstupovat do vodíkové vazby s vodou.
Klíčové poznatky
- Chcete-li dát etherům obecné názvy, jednoduše pojmenujte skupiny připojené k atomu kyslíku, za nimiž následuje obecný název ether. Pokud jsou obě skupiny stejné, měla by názvu skupiny předcházet předpona di-.
- Molekuly éterů nemají žádnou OH skupinu, a tudíž ani mezimolekulární vodíkovou vazbu. Etery mají proto při dané molární hmotnosti poměrně nízké teploty varu.
- Molekuly etherů mají atom kyslíku a mohou se zapojit do vodíkové vazby s molekulami vody. Molekula éteru má přibližně stejnou rozpustnost ve vodě jako alkohol, který je s ní izomerní.
Cvičení
-
Jak může ethanol při zahřívání s kyselinou sírovou dávat dva různé produkty? Vyjmenujte tyto produkty.
-
Který z těchto etherů je izomerní s ethanolem – CH3CH2OCH2CH3, CH3OCH2CH3 nebo CH3OCH3?
-
Jmenujte každou sloučeninu.
- CH3OCH2CH2CH3
-
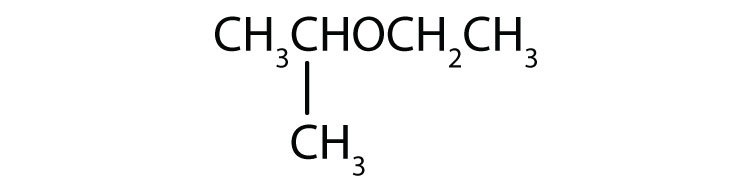
-
Jmenujte každou sloučeninu.
- CH3CH2CH2CH2OCH3
- CH3CH2OCH2CH2CH3
-
Nakreslete strukturu každé sloučeniny.
- methyl ethylether
- terc-butyl ethylether
-
Nakreslete strukturu pro každou sloučeninu.
- diizopropylether
- cyklopropylpropylether
Odpovědi
-
Intramolekulární (H i OH pocházejí ze stejné molekuly) dehydratací vzniká ethylen; intermolekulární (H pochází z jedné molekuly a OH pochází z jiné molekuly) dehydratací vzniká diethylether.
-
- methylpropylether
- ethylisopropylether
.
-
- CH3OCH2CH3
-
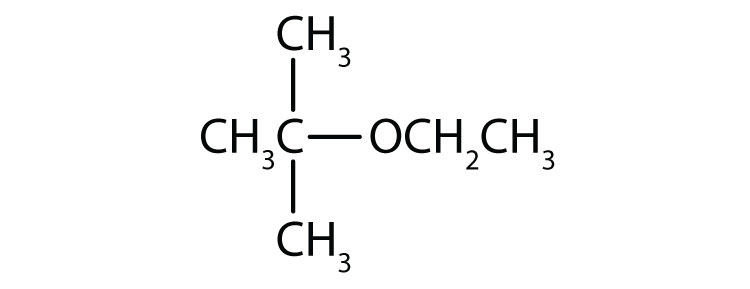
.
Napsat komentář