Varför är vatten syra i reaktionen med ammoniak?
Detta är en bra reaktion i allmän kemi med viktiga konsekvenser för organisk kemi. En annan liknande fråga är: Varför är vatten en bas när det reagerar med en ”syra”? Svaret på båda frågorna är: Allt är relativt! Här på StudyOrgo får vi ofta sådana här frågor om ämnen i organisk kemi som vanligtvis behandlas snabbt, beskrivs dåligt eller förväntas som du känner till från tidigare kurser. Dessa begrepp är verkligen viktiga för att förstå de mer komplexa ämnena som kommer att komma. Med ett medlemskap hos StudyOrgo får du ännu fler tips och tricks om ämnen inom organisk kemi och detaljerade mekanismer med förklaringar. Dagens blogg är en förhandsvisning av de detaljerade ämnen och material som finns tillgängliga. Kolla in ett medlemskap på StudyOrgo.com och registrera dig idag!
Håll dig i minnet att när det gäller syror och baser finns det två definitioner; Bronsted- och Lewis-definitionen. Bronsted-syror definieras som protongivare, medan Lewis-syror definieras som elektronacceptorer. Båda är syror, men det vi tänker olika på är om protoner eller elektroner är inblandade. I en vattenlösning, allmän kemi eller biokemi tänker vi främst på Bronsted-definitionen eftersom dissociationen av protoner från syror förändrar koncentrationen av H+ i lösningen, vilket vi tolkar som en förändring av pH-värdet och lösningens ”surhet”. Vi mäter dissociationen av protoner från syror, eller acceptansen av protoner av baser, med ett numeriskt värde som är pKa. Ju större pKa, desto svagare är syran och desto starkare är basen. Ju lägre pKa desto starkare syra och svagare bas. Ett enkelt knep för att tänka på pKa är att placera den protonerade versionen av molekylen till vänster och tänka på den som en protongivare. PKa anger hur lätt denna donation kommer att vara, ju lägre siffra desto lättare protondonation.
Låt oss titta på reaktionen mellan ammoniak och vatten; pKa för vatten är definierad som 14. Ammoniakens pKa är ~37.
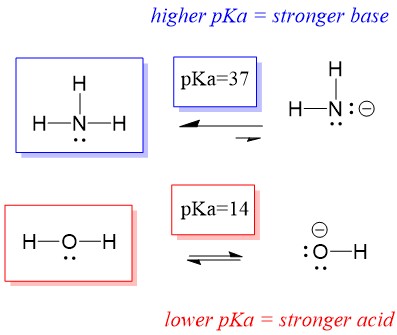
Då vattens pKa är lägre än ammoniakens, är det en starkare syra än ammoniak och kommer att donera protoner till ammoniakbasen. Denna reaktion leder till att vatten blir den konjugerade basen OH- och ammoniak blir den konjugerade syran NH4+. Intressant nog är detta anledningen till att ammoniak är ett kaustikum, den producerar hydroxid som reagerar med fläckar och mikroorganismer för att effektivt rengöra och desinficera hushållsartiklar.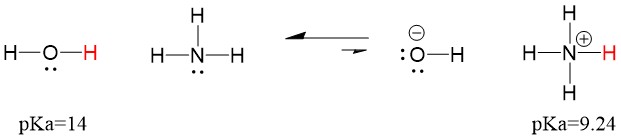
Detta är viktigt som ett begrepp inom organisk kemi eftersom styrkan hos syror och baser i termer av elektroner, eller Lewis-definitionen, är exakt så som vi tänker på mekanismer för att bryta och bilda bindningar; flödet av elektroner. Styrkan hos Lewis-syror och den konjugerade syran kan hjälpa till att identifiera i vilken riktning en reaktion kommer att gå. Vi kan se att reaktionen mellan vatten och ammoniak är ogynnsam, men tillräckligt mycket av reaktionen sker i verkligheten för att avsevärt sänka vattnets pH (pH~11 med ammoniak).
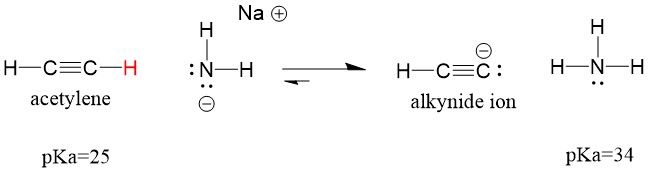
Låt oss titta på en acetylen som reagerar med en bas för att generera en alkynidjon, en användbar nukleofil för bildning av C-C-bindningar. Om vi försöker låta natriumhydroxid reagera med alkylen kommer alkynidjonen INTE att bildas. Detta beror på att den konjugerade syraprodukten av reaktionen är vatten, som har en pKa på 15, är STARKARE än den ursprungliga syran acetylen (pKa = 25). Reaktioner gynnar ALLTID bildandet av den svagare syran, eller i detta fall reaktorsidan.
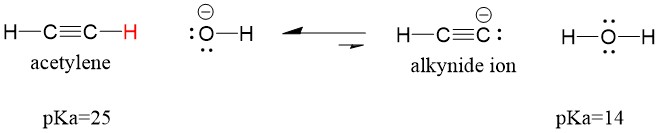
Om vi ändrar vår bas till natriumamid, som är en mycket starkare bas, kommer alkynidjonen att bildas. Detta beror på att den konjugerade syraprodukten i reaktionen är ammoniak, som har en pKa på 38, och är en VÄKARE konjugerad syra än den ursprungliga syran acetylen (pKa = 25). I detta fall gynnar reaktionen produktsidan!

Lämna ett svar