Vad har DNA-minipreparat och immunutfällningsexperiment för proteiner gemensamt? De börjar på olika sätt, men de slutar med samma kritiska steg – eluering. Men vad exakt är eluering och vad är poängen?
Terminologin
Först ska vi börja med lite grundläggande terminologi:
Eluering – att extrahera ett material från ett annat genom att tvätta med ett lösningsmedel.
Absorbenten – en fast fas, som kan vara en kiselgel när det gäller mini-prep-kolonner, men vanligtvis pärlor som kan kopplas kovalent till antikroppar eller andra ligandmolekyler. ”Fast fas” betyder inte nödvändigtvis en stående kolonn; det kan vara pärlor i en eppendorf som är lätta att tvätta.
Affinitet – ett mått på absorbentens förmåga att binda den valda molekylen (det du försöker eluera). Ju högre affinitet den fasta fasen har till valfri biomolekyl (BOC), desto tätare binds molekylen till den. Du vill dock inte att bindningen ska vara irreversibel, då blir elutionen omöjlig.
Eluent – ett lösningsmedel som avlägsnar BOC från absorbenten.
Eluat – lösningsmedlet som innehåller BOC som avlägsnats från adsorbenten.
Materialförberedelse
Innan elutionen måste du absorbera valfri molekyl samtidigt som du gör dig av med kontaminering. Detta är ett viktigt steg, eftersom den konventionella visdomen påminner oss om ”skräp in, skräp ut”. Du kan ha utmärkta reagenser för eluering, men om ditt prov innehåller för mycket av den orelaterade personalen (den vetenskapliga termen är ”gunk”) kommer den att täppa till adsorptionsmaterialet. Fastfasmättnad kommer att hindra din BOC från att absorberas och sedan kontaminera eluatet. De effektiva lyserings- och reningsstegen är viktiga för att ditt elueringsexperiment ska lyckas.
Det är viktigt att bestämma volymen av ditt förabsorptionsmaterial. Volymen lysat som passerar genom absorptionsmediet bör inte överstiga 3 – 5 volymer av kolonnen. Den stora volymen lysat som passerar genom absorptionsmedlet ökar experimentets tidsåtgång samt sannolikheten för att skräp absorberas. I många fall är det värt att minska den ursprungliga lysatvolymen genom filtrering eller fraktionering. Lysatvolymen bestämmer således kolonnens storlek.
Valet av adsorptionsmaterial beror på den kemiska sammansättningen av din intressanta molekyl. Absorptionen av biomolekyler innebär vanligtvis en mer eller mindre specifik interaktion mellan substratet och molekylen. Till exempel absorberas DNA på minikolonner på grund av jonisk interaktion mellan negativt laddade DNA-fosfatgrupper och positivt laddade kiseldioxidpartiklar.
Proteiner adsorberas vanligen på sefaros eller magnetiska pärlor som är täckta med IgG.
Efter en första lysattillförsel kan din kolonn inte torka ut någonstans. Detta kommer att ”baka din” molekyl på absorbenten och störa kolonnens integritet. Om du inte har tid att fortsätta experimentet, fyll på kolonnen med en kompatibel buffert och stoppa flödet.
Tvätt
Syftet med att tvätta den fasta fasen är att avlägsna ett icke-relaterat material, medan den intressanta molekylen lämnas kvar på kolonnen. Den selektiva separationen uppnås ofta genom att använda en buffert med låg jonstyrka (t.ex. låg saltkoncentration). Volymen av tvättbufferten bör ligga nära mängden av det ursprungliga materialet och vara minst 3-5 volymer av kolonnen.
Efter att flera volymer av tvättbufferten passerat genom kolonnen kommer dock föroreningarna att tvättas bort och ytterligare tvätt kommer inte att förbättra kvaliteten på din prep. Dessutom kommer du att börja förlora ditt målmaterial.
Elution
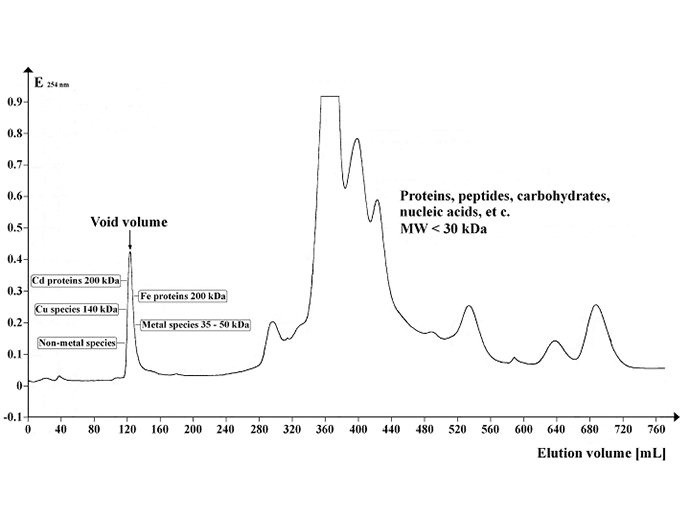
Bild: Kromatogram som visar UV-absorptionsprofilen för Arabidopsis supernatant separerad på Sephadex G-50 Superfine. Gelvolym: 500 ml, kolonnlängd: 700 mm, kolonndiameter: 30 mm, flödeshastighet för eluent: 12 mL/timme, fraktionsvolym: 8,0 mL, antal fraktioner: 95, provvolym: 5 mL, separationstemperatur: Separeringstemperatur: 4 °C: 20 mM Tris-HCl, 1 mM NaN3, pH 8,0. Bildkredit: https://commons.wikimedia.org/wiki/File:Chrom_SephG-50.tif
Elution i sig fungerar eftersom du bryter bindningarna mellan kolonnen och substratet (t.ex. genom att använda högt salt eller hög temperatur på eluenten). Elueringen sker vanligen i en liten volym buffert som är kompatibel med provförvaring och ytterligare tillämpningar.
DNA-eluering från mini-prep-kolonnen är det enklaste fallet: en volym buffert avlägsnar nästan allt DNA. Koncentrationen av DNA i eluatet är omvänt proportionell mot den elutionsbuffert som används: ju mer buffert du använder, desto lägre blir den slutliga DNA-koncentrationen. Även i detta fall rekommenderar dock de flesta tillverkare att man använder ytterligare en volym för att avlägsna allt DNA.
För kolonnerna är elutionshastigheten kritisk. För långsam hastighet ökar risken för nedbrytning av molekylen; för snabb och det blir ingen upplösning av fraktionerna.
För kolonner med stor volym måste du samla in eluatfraktioner eftersom din molekyl kommer att fördelas mellan dem. Den första fraktionen kommer att innehålla en blandning av tvätt- och elutionsbuffert och eventuell kontaminering som inte avlägsnas av tvättbufferten.
Du kan övervaka OD för din typ av molekyl (260nm/280nm för DNA) och göra ett blot för din specifika molekylkoncentration i varje fraktion. I det enklaste fallet kommer din molekylfördelning att följa en enkel klockkurva, men den kan ha en eller flera skarpa toppar.
Slutningsvis, om du känner till de grundläggande parametrarna för ditt experiment (absorbent, kolonnstorlek, tvättbuffert, elutionsbuffert, flödeshastighet, antal fraktioner) och de allmänna principerna för eluering, kommer du att kunna ställa in din eluering på ett framgångsrikt sätt.
För mer detaljer hittar du en artikel där andra forskare har gjort något liknande – helst samma molekyl, men en liknande räcker – och anpassar den till dina förhållanden.
Lämna ett svar