Från Proteopedia
proteopedia länkproteopedia länk
Lysozym – även känt som muramidas – är ett kraftfullt enzym som finns i riklig mängd i tårar, saliv och mänsklig mjölk. Hos människor kodas det i LYZ-genen. Eftersom det är ett litet, lättillgängligt och mycket stabilt protein har det varit föremål för omfattande forskning om dess funktion och struktur.
Introduktion
Lysozym fungerar som ett ospecifikt försvar mot bakterier och svampar. Det är en komponent i det medfödda immunförsvaret och är en viktig del av ett spädbarns kost för att avvärja diarré. Det är ett enzym som är känt för sin förmåga att bryta ned polysackaridarkitekturen i många typer av cellväggar, normalt i syfte att skydda mot bakteriell infektion. Strukturen hos lysozym från hönsäggvita (HEW), som är i fokus för den här artikeln, visas till höger. Den antibakteriella aktiviteten hos hönsäggvita beskrevs först av Laschtschenko 1909. Den karakteriserades och benämndes ”lysozym” av Alexander Fleming, samma person som krediterades för upptäckten av penicillin. Upptäckten av den enzymatiska aktiviteten skedde av en slump; under det orelaterade experimentet fördes näsdropp oavsiktligt in i en petriskål som innehöll en bakteriekultur, vilken kultur följaktligen uppvisade resultaten av en ännu okänd enzymatisk reaktion. Observationen av denna okända reaktion ledde till ytterligare forskning om reaktionens komponenter samt till motsvarande identifiering av det nyfunna ”lysozym”. År 1965 fastställde David C. Phillips och medarbetare lysozymets tredimensionella struktur med en upplösning på 2 Å . Phillips arbete var särskilt banbrytande eftersom Phillips hade lyckats klarlägga strukturen hos ett enzym med hjälp av röntgenkristallografi – en bedrift som aldrig tidigare hade lyckats. Phillips forskning ledde också till en strukturbaserad hypotes om dess verkningsmekanism.
Funktion
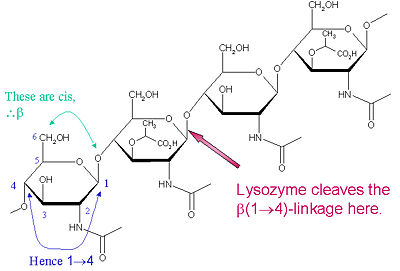
Det särskilda substratet som föredras för denna klyvningstyp är en (NAG-NAM)₃ hexasackarid, inom vilken substratet förekommer den klyvningsbara målglykosidbindningen, NAM₄-β-O-NAG₅. De enskilda hexasackaridbindningsenheterna betecknas A-F, med NAM₄-β-O-NAG₅ glykosidbindningsklyvningspreferens motsvarande en D-E-enhets glykosidbindning cl
Lysozym är känt för att skada bakteriella cellväggar genom att katalysera hydrolysen av 1,4-beta-bindningar mellan N-acetylmuraminsyra (NAM) och N-acetyl-D-glukosaminrester (NAG) i peptidoglykan och mellan N-acetyl-D-glukosaminrester i chitodextriner. På detta sätt är lysozym effektivt när det gäller att lysera cellväggarna hos både bakterier och svampar. Lysozymets klyvningsplats i detta arkitektoniska tema är den β(1-4)-glykosidiska bindningen som förbinder C1-kolämnet i NAM med C4-kolämnet i NAG.
Det särskilda substratet som föredras för denna klyvningstyp är en (NAG-NAM)₃ hexasackarid, inom vilket substrat förekommer den klyvande målglykosidbindningen, NAM₄-β-O-NAG₅. De enskilda hexasackaridbindningsenheterna betecknas A-F, med NAM₄-β-O-NAG₅ glykosidbindningspräferens som motsvarar en D-E-enhets glykosidbindningspräferens som motsvarar D-E-enhetens glykosidbindningspräferens. Beroende på den organism från vilken lysozym erhålls sker hydrolys av glykosidbindningen med bibehållen konfiguration vid det anomeriska kolet (hönsäggvita) eller med inversion (gås, fag T4).
Lysozym agerar effektivt på långa (NAG-NAM) eller (NAG) polymerer. När kedjelängden blir mindre än sex monomerer sjunker de katalytiska hastigheterna avsevärt; i själva verket fungerar trisackarider som kompetitiva hämmare genom att de binder sig till den aktiva platsen i ett icke-produktivt register.
Hen äggvita lysozym (PDB-kod 1hew)
Mekanism
Hydrolys av glykosidiska bindningar av hönsäggsvit lysozym sker med bibehållen konfiguration. År 1953 föreslog Koshland att bibehållen konfiguration i allmänhet innebär en mekanism med dubbel förskjutning (medan inversion av konfiguration innebär enkel förskjutning). Under årtionden har man övervägt två konkurrerande mekanistiska hypoteser (Phillips: dissociativ mekanism med en oxokarbeniumintermediär; Koshland: associativ mekanism i två steg med ett kovalent enzymkomplex som intermediär), med uppgifter från 2001 som har lett till att det finns en kovalent intermediär. Avsaknaden av en substratkomplexstruktur bidrog säkert till svårigheterna att skilja mellan möjliga mekanismer, liksom förekomsten av två olika mekanismer (retention och inversion av konfiguration) inom samma strukturella enzymfamilj (t.ex. hen vs goose enzym).
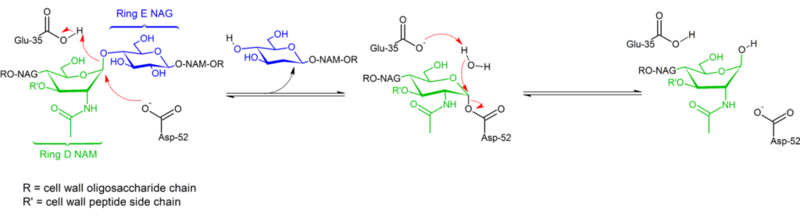
Lysozym hydrolyserar en glykosid (därav lysozymets familjeklassificering som ett glykosylas), vilket motsvarar omvandlingen av en acetal till en hemiacetal. Reaktionen sker i två steg enligt figuren ovan. I det första steget agerar Asp 52 som nukleofil och en del av sockret utgör avgångsgruppen. I det andra steget fungerar vatten som nukleofil och Asp 52 som avgående grupp. Båda stegen inverterar konfigurationen vid det anomeriska kolet, vilket leder till att konfigurationen totalt sett bibehålls. Glu 35 fungerar som en syra i det första steget (protonerar sockret i den glykosidiska bindningen för att göra det till en bättre elektrofil) och som en bas i det andra steget (deprotonerar vatten för att göra det till en bättre nukleofil). Även om figuren visar några av sockerarterna i en båtkonformation för att betona inverteringen av konfigurationen, observeras dessa inte experimentellt utan återfinns snarare i en stolskonformation.
Tillämpningar av lysozym
Då lysozym har blivit allmänt erkänt för sina antibakteriella och svampdödande egenskaper har det ett stort antal olika användningsområden både inom biokemiska och farmaceutiska tillämpningar. Inom molekylärbiologin används lysozym ofta i det alkaliska analysförfarandet för att extrahera och isolera plasmid-DNA. Det används flitigt inom läkemedelsområdet för att förstöra grampositiva bakterier och kan användas för att stödja redan existerande immunförsvar för att bekämpa bakterieinfektioner. Detta enzym är särskilt viktigt för att förebygga bakteriesjukdomar hos spädbarn. På grund av sina antibakteriella egenskaper kan lysozym också användas inom livsmedelsindustrin för att förhindra att livsmedel förstörs.
Se även
- Lysozym 3D-strukturer
- Lysozym
- Återhållande glykosidhydrolaser
- Molekylär lekplats/Lysozym
- Användare:Judy Voet/Lysozym
- Lysozym (arabiska)
- Lysozym (hebreiska)
- Ragland SA, Criss AK. Från bakteriedödning till immunmodulering: Nya insikter om lysozymets funktioner. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Strukturen hos lysozym från hönsäggvita. En tredimensionell Fourier-syntes med 2 Angströms upplösning. Natur. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. An Introduction to Enzyme and Coenzyme Chemistry. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Kristallografiska studier av aktiviteten hos lysozym från hönsäggvita. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Bild från: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Tidiga bandritningar av proteiner. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Strukturen hos lysozym från hönsäggvita. En tredimensionell Fourier-syntes med 2 Angströms upplösning. Natur. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Strukturen hos vissa kristallina lysozym-inhibitorkomplex bestämda genom röntgenanalys med 6 Angströms upplösning. Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. Katalys av lysozym från hönsäggvita går via en kovalent intermediär. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers och Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia Page Contributors and Editors (vad är detta?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
Lämna ett svar