Nyckelord
CADASIL – stroke – MRI
Introduktion
Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leucoencephalopathy (CADASIL) är en ärftlig sjukdom i små artärer som orsakas av olika patogenetiska mutationer i NOTCH-3-genen. Den kännetecknas av migrän med aura, psykiatriska symtom, återkommande ischemiska händelser i tidig ålder och kognitiv nedsättning. Detta och dess typiska radiologiska fynd är det som normalt hjälper oss att misstänka sjukdomen. Den anses vanligen vara en sjukdom hos unga och medelålders vuxna, men fall hos äldre kan vara underdiagnostiserade. Vi rapporterar fallet med en man som fick diagnosen CADASIL i slutet av sjuttiotalet tack vare den tidigare diagnosen hos hans dotter.
Fallrapporter
Fall 1
Vår patients dotter var 50 år gammal när hon skickades till vårt sjukhus från den neurologiska öppenvårdskliniken för vidare undersökning, på grund av de radiologiska fynden i hennes MRT-skanning av hjärnan, som bestod av förändringar i den vita substansen i båda de yttre kapslarna, bilaterala periventrikulära områden och vänster temporallob.
Hon kom till ovannämnda klinik eftersom hon hade lidit av migrän med visuell aura i 30 år, med vissa episoder som tydde på visuell aura utan huvudvärk. Hon hade inga andra symtom. Hon var allergisk mot fosfomycin och hade genomgått tonsillektomi när hon var barn. Hon hade ingen annan tidigare sjukdomshistoria. Hennes familjehistoria var anmärkningsvärd: hennes mor hade migrän och mild demens och hennes far fick en stroke vid 75 års ålder; hennes farfar, farbror och moster hade haft stroke och farbrodern hade fått diagnosen Alzheimers sjukdom, en faderlig kusin hade på annat håll fått diagnosen ”ANA+ vaskulit” och en annan faderlig kusin hade fått diagnosen multipel skleros. Hon hade två friska söner. Fysisk undersökning, inklusive en noggrann neurologisk undersökning, var helt normal. Den upprepade MRT-undersökningen av hjärnan visade multipla hyperintensiva lesioner i den vita substansen i posterior protuberans, periventrikulära och subkortikala områden, inklusive främre temporalloberna, särskilt den vänstra, båda centrum semiovale, inre och yttre kapslar, utan tecken på nyligen eller tidigare mikroblödningar (figur 1). Alla övriga undersökningar, inklusive hemogram, glukemi, lever- och njurfunktion, erytrocytsedimentationshastighet, serumsköldkörtelhormoner, screening av hyperkoagulabilitet, vaskulit-screening, EKG, röntgen av bröstkorgen, syfilis- och hiv-serologier samt ultraljud av supraaortiska stammar med doppler, var normala med undantag för en kolesterolemi på 220 mg/dl med ett LDL-kolesterol på 152 mg/dl. Hudbiopsin var också normal. En Arg169Cys-mutation (byte av cytosin mot tymin i kodon 505) hittades i det fjärde exonet av NOTCH 3-genen, vilket är känt för att vara patogenetiskt, så hon fick diagnosen CADASIL. Med denna diagnos utvärderades båda föräldrarna på vår klinik.
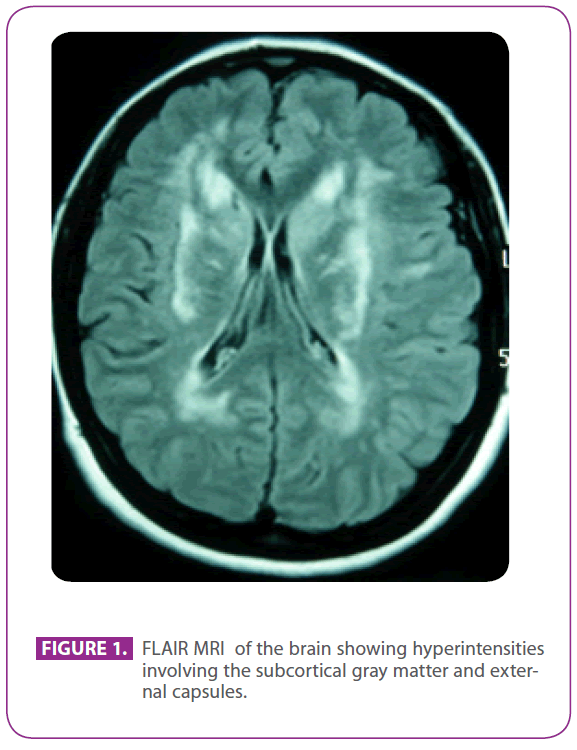
Figur 1: FLAIR MRI av hjärnan som visar hyperintensiviteter som involverar den subkortikala grå substansen och externa kapslar.
Fall 2
Hennes mor var 78 år gammal. Hon hade en lång historia av migrän utan aura och hade under de senaste två åren utvecklat en mild demens med symmetrisk parkinsonism, fluktuationer och REM-sömnbeteendestörning, vilket tyder på demens med Lewy-kroppar. Hennes far var en 79-årig man med flera vaskulära riskfaktorer: diabetes mellitus typ 2, dyslipidemi och rökning i 50 år, med ett ackumulerat index på 15 paketår, även om han hade slutat för tre år sedan. Han hade ischemisk hjärtsjukdom med en posteroinferior myokardinfarkt 1991. Under de senaste 8 åren hade han haft tre transitoriska ischemiska olyckor och en lacunär stroke som motsvarade olika arteriella territorier, med progressivt nedsatt gångförmåga, och under de senaste 6 månaderna hade han blivit lite tillbakadragen och apatisk. Han hade ingen historia av migrän. Han stod på metformin, klopidogrel, atenolol och atorvastatin. Vid fysisk undersökning var han vid medvetande och orienterad men lite ouppmärksam, språket och fjärr- och närminnet var normalt, han uppvisade ideomotorisk apraxi, förändrad likhets- och ordtolkning, utan frontala frigöringsreflexer. Han uppvisade också global hyperreflexi med bilaterala flexor plantarreflexer och en gång med korta steg och reducerade armrörelser. En datortomografi som utfördes två år tidigare, efter en av hans transitoriska ischemiska attacker, visade omfattande sjukdom i den vita substansen, särskilt framträdande i den yttre kapseln och temporalloberna (figur 2).
Sammanfattningsvis hade patienten återkommande ischemiska slaganfall, lindrig subkortikal kognitiv nedsättning och leukoencefalopati, mycket misstänkt för CADASIL med tanke på hans dotters diagnos. Ett genetiskt test utfördes som visade samma NOTCH 3-mutation som dottern och bekräftade diagnosen.
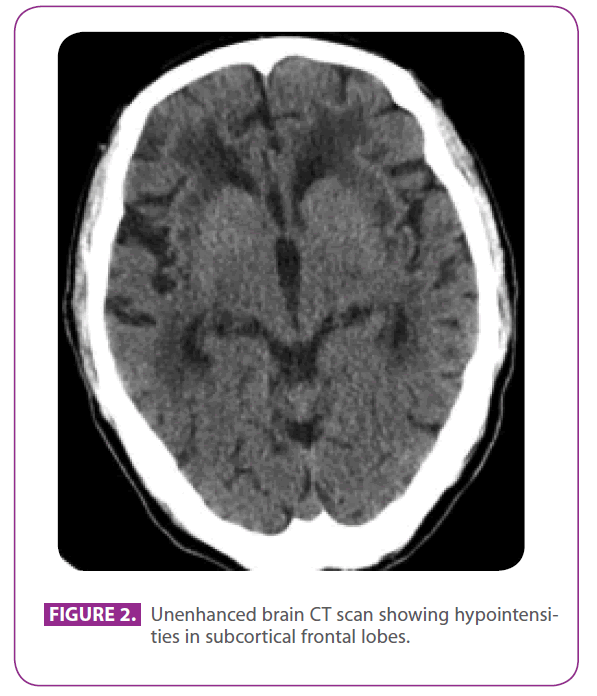
Figur 2: Unenhanced brain CT scan showing hypointensities in subcortical frontal lobes.
Discussion
CADASIL är den vanligaste ärftliga sjukdomen med små kärl. Den kan dock även vara sporadisk, eftersom de novo-mutationer har beskrivits. Den orsakas av olika patogena mutationer i NOTCH-3-genen, som är belägen på kromosom 19, locus 19p13.2-p13.1, och består av 33 exoner som kodar för ett protein med 2321 aminosyror (1). Detta protein är en enkelpassande transmembranreceptor på cellytan som uttrycks i systemiska arteriella glatta muskelceller, med en extracellulär regulatordomän och en intracellulär transduktordomän. Hittills har det rapporterats mer än 190 mutationer som kan leda till CADASIL, och alla förekommer i exon 2-24 av NOTCH 3-genen, som kodar för de 34 epidermala tillväxtfaktorliknande upprepningarna i NOTCH 3:s extracellulära del. Screening av dessa 23 exoner har därför 100 % känslighet och nästan samma specificitet (2). Av dessa mutationer är mer än 180 missense-mutationer, minst 6 deletioner, en insättning, en ramförskjutning och 2 duplikationer. De flesta patogenetiska NOTCH3-mutationer förekommer i exon 3 och 4 (3).
Alla mutationer resulterar i ett tillägg eller en förlust av en cysteinrest i en EGF-liknande upprepning, och därmed ett udda antal cysteinrester som ger upphov till bildandet av onormala disulfidbryggor. Den muterade NOTCH3 orsakar degeneration av glatta kärlceller i små artärer och arterioler och ackumulering av det onormala proteinet i väggen i dessa kärl, vilket leder till stenos i lumen (1). I hjärnan påverkar den penetrerande cerebrala och leptomeningeala artärer, vilket framkallar oförmåga hos dessa kärl att autoreglera och hypoperfusion av de områden som bevattnas av dem, och därmed infarkter i den vita substansen.
Det första symtomet på CADASIL, när det uppträder, är vanligtvis migrän med aura, med en genomsnittlig debutålder på 30 år. Det uppträder hos 20 till 40 % av patienterna (4). De flesta attacker är typiska med visuell eller sensorisk aura, men hälften av patienterna har också atypiska attacker med basilarisk, hemiplegisk eller långvarig aura.
Subkortikala ischemiska händelser, övergående attacker eller stroke, uppträder hos 60 till 85 % av patienterna, den första vid en genomsnittsålder på 50 år, även om den kan uppträda redan under det andra decenniet. Oftast finns det inga konventionella vaskulära riskfaktorer eller så är de inte särskilt viktiga. Hos två tredjedelar av patienterna uppträder de ischemiska händelserna kliniskt och radiologiskt som lacunära syndrom. De flesta av patienterna har flera slaganfall, vanligen 2 till 5, som efter flera år leder till gångsvårigheter, urin- och avföringsinkontinens, demens och pseudobulbar pares (1). Kognitiv nedsättning är den näst vanligaste kliniska manifestationen. Det tidigaste tecknet är vanligen försämring av de exekutiva förmågorna och bearbetningshastigheten, vilket förekommer hos de flesta patienter som är äldre än 35 år, men kan uppträda så tidigt som under det första levnadsdecenniet (5). Denna kognitiva försämring är progressiv och förvärras normalt vid återkommande stroke, med tillägg av försämring av instrumentella aktiviteter, minne, språk, resonemang och visuospatiala förmågor. Över 70 % av patienterna är dementa under det sjätte levnadsdecenniet. Allvarlig afasi, apraxi eller agnosi är sällsynta hos CADASIL.
Psykiatriska störningar, främst humörstörningar, förekommer hos 20 % av patienterna, i allmänhet i form av allvarliga depressiva episoder. Apati förekommer hos 40 % av patienterna och har inget samband med depression Andra mindre vanliga kliniska manifestationer är akut reversibel encefalopati (6) (hos 10 % av patienterna), varav de flesta uppträder efter en migrän med aura, kramper (hos 5-10 % av patienterna), dövhet, parkinsonism, hjärnblödningar (oftast hos patienter med högt blodtryck) och hjärtinfarkt.
Trots sin fullständiga penetrering har CADASIL en viktig inter- och intrafamiljär klinisk uttrycksvariabilitet. Samma NOTCH-3-mutation har ett brett kliniskt spektrum utan tydliga skillnader mellan homozygota och heterozygota patienter. Det finns faktiskt ingen korrelation mellan genotyp och klinisk fenotyp (4). Orsaken till dessa skillnader är inte känd, men vissa möjliga fenotypmodifierare av CADASIL har beskrivits, som nuvarande rökning för risken för stroke och åldern för den första stroken, högt blodtryck för risken för stroke eller homocysteinnivåer för åldern för debut av migrän (3,4). Dessa och andra faktorer kan påverka sjukdomens kliniska uttryck genom att modifiera genuttrycket eller genom att påverka andra fysiopatologiska vägar som kan leda till samma kliniska manifestationer.
Radiologiska förändringar uppträder hos alla individer med en CADASIL-mutation före 35 års ålder och ökar med tiden. De tidigaste och mest frekventa kännetecknen är hyperintensiva icke-förstärkande punktformiga områden i cerebral vit substans och subkortikala strukturer i T2-viktade och fluid-attenuated inversion recovery-bilder från MRT. Involvering av externa kapslar och den främre delen av temporalloberna är typiskt för dessa sjukdomar och en ledtråd för diagnosen, eftersom de hjälper till vid differentialdiagnostik med andra tillstånd såsom småkärlssjukdom (1).
CADASIL anses vanligen vara en sjukdom hos unga och medelålders vuxna, men antalet äldre patienter kan vara underdiagnostiserat (7,8). Vårt andra fall kan tjäna som exempel: en 79-årig patient med vaskulära riskfaktorer och återkommande stroke, med sjukdom i den vita substansen som av flera neurologer ansågs vara sekundär till småkärlssjukdom. Diagnosen ställdes först efter att man fick kännedom om hans dotters mutation. I fall utan tydlig familjehistoria kan ett öppet sinne och noggrann uppmärksamhet på suggestiva radiologiska fynd, t.ex. medverkan av den yttre kapseln eller främre tinningloberna, vara den enda ledtråden för en korrekt diagnos.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: en fallserie med 11 patienter. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. Kliniskt spektrum av CADASIL och effekten av kardiovaskulära riskfaktorer på fenotypen: studie av 200 konsekutivt rekryterade individer. Stroke 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. Genetiska och kardiovaskulära riskfaktorers inverkan på CADASIL-fenotypen. Brain. 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepezil hos patienter med subkortikal vaskulär kognitiv nedsättning: en randomiserad dubbelblind studie i CADASIL. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. ”CADASIL coma”: en underdiagnostiserad akut encefalopati. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. Homozygositet för en NOTCH3-mutation hos en 65-årig CADASIL-patient med milda symtom: en familjerapport. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. Den anmärkningsvärt varierande expressiviteten hos CADASIL: rapport om en man med minimala symtom i hög ålder. J Neurol. 2009;256:1026-7
Lämna ett svar