Resultat
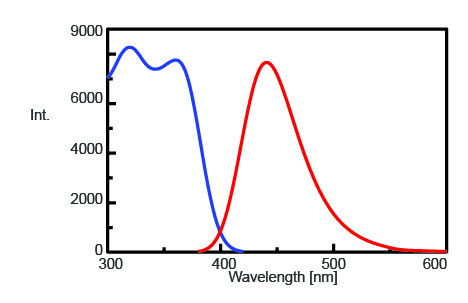
För att hitta den maximala emissionsvåglängden för att övervaka fluorescensintensiteten hos AMC efter trypsinklyvning mättes excitations- och emissionsspektren, som visas i figur 1. Den maximala emissionsvåglängden är 440 nm.
För att standardisera den uppmätta fluorescensintensiteten i enzymlösningen till koncentrationen av isolerad AMC utfördes en titrering och fluorescensen mättes. 0,5 mL alikvot av en 50 µmol/L AMC-lösning tillsattes till en 2,5 mL enzymlösning och de initiala och slutliga koncentrationerna av isolerad AMC sammanfattas i tabell 1.
Tabell 1. Koncentrationer av isolerad AMC före och efter standardisering av fluorescensintensiteten.
| Initialkoncentration | 3 | 6 | 15 | 30 | 60 | 120 | 240 |
| Finell koncentration | 0.5 | 1 | 2,5 | 5 | 10 | 20 | 40 |
Trypsinaktivitetens kinetik erhölls sedan genom att mäta fluorescensintensiteten hos isolerad AMC vid klyvning av trypsin från substratet. Figur 2 visar tidsförloppsmätningen efter att 0,5 mL av varierande koncentrationer av substratlösningen Boc-Gln-Ala-Arg-MCA tillsattes till 2,5 mL av enzymlösningen.
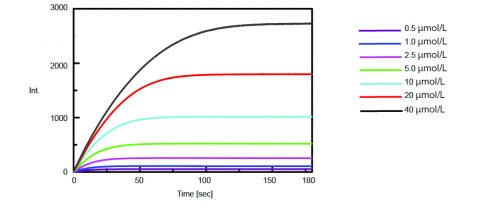
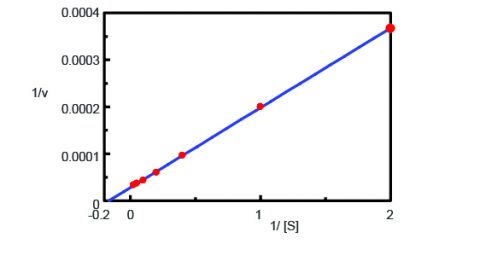
Med hjälp av programmet Kinetics Analysis ritades en Lineweaver-Burk-graf (figur 3) från fluorescenstidsmätningarna i figur 2. Lineweaver-Burk-grafen ger enzymkinetiska parametrar som den maximala reaktionshastigheten, Vmax, och Michaelis-Menten-konstanten, Km. Vmax beskriver reaktionshastigheten när enzymet är mättat med substrat medan Km anger mängden substrat för att nå den maximala reaktionshastigheten. Vmax var 35 270 nmol/L-min-1 och Km var 5,99. Linjens ekvation var 1/v = 0,000270 – 1/ + 0,0000284.
Lämna ett svar