Dipol – dipolkrafter
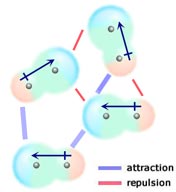
Om två neutrala molekyler, som var och en har ett permanent dipolmoment, möts på ett sådant sätt att deras motsatt laddade ändar ligger i linje med varandra, kommer de att attraheras av varandra. I en vätska eller ett fast ämne gynnas dessa inriktningar framför de där lika laddade ändar av molekylerna ligger nära varandra och därmed stöter bort varandra.
En anledning till att CH3F har en högre kokpunkt (-84 °C) än CF4 (-128 °C) är att CF3H har ett permanent dipolmoment, medan CF4 inte har det. För att fullt ut förstå detta måste man veta att CF4 har tetraederform och CH3F är grovt tetraederformad (det är ingen större skillnad mellan dessa molekylers former). Kol-fluor-bindningarna i båda molekylerna är polära (fluor är mycket mer elektronegativt än kol), men närvaron av fyra C-F-bindningar i den tetraedriska CF4-molekylen gör molekylen totalt sett opolär. Dipolmomentet hos den enda C-F-bindningen i CH3F upphävs inte av dipolerna hos C-H-bindningarna (som är mycket små), så CH3F har ett permanent dipolmoment.
En typ av intermolekylär kraft som kan uppstå under särskilda omständigheter och som vanligtvis klassificeras som en dipol-dipolinteraktion, även om den har en viss kovalent bindningskaraktär, är vätebindning.
Lämna ett svar